
����Ŀ������˵����ȷ����
A.��FeCl3��Һ��Fe2(SO4)3��Һ�ֱ���ȡ����ɡ����գ����ù���ɷ���ͬ
B.ˮ�ⷴӦNH4+��H2O![]() NH3H2O��H���ﵽƽ��������¶�ƽ�������ƶ�
NH3H2O��H���ﵽƽ��������¶�ƽ�������ƶ�
C.CH3COONa��Һ�м���CH3COOH�ܴٽ�CH3COO��ˮ��
D.�����£�Ũ�Ⱦ�Ϊ0.1molL-1 NaCN��HCN���Һ��pH��9����c(HCN)��c(Na+)��c(CN��)��c(OH��)��c(H+)
���𰸡�D
��������
A��FeCl3ˮ�������������������ᣬ�����ӷ������ȡ�����������������Fe2��SO4��3��Һ���ȡ����ɡ������Եõ����������������ѻӷ�����A�����
B.ˮ����������ȵĹ��̣������¶ȣ�ˮ��ƽ�������ƶ�����B�����
C.CH3COONa��Һ����ˮ��ƽ��CH3COO-+H2OCH3COOH+OH-�����Լ���CH3COOH������CH3COO-ˮ�⣬�����Ǵٽ�����C�����
D�������Һ��pH=9˵����Һ�ʼ��ԣ�c��OH-����c��H+������NaCNˮ��̶ȴ���HCN����̶ȣ�����������ˮ��̶ȶ���С�����Դ���c��HCN����c��Na+����c��CN-����c��OH-����c��H+������D����ȷ��
�ʴ�ΪD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��10 mL 0.1mol��L��1Na2CO3��Һ����μ���0.1 mol��L��1HCl��Һ20 mL����Һ�в��ֺ�̼�������ʵ�������ҺpH�ı仯��ͼ��ʾ������˵������ȷ����

A��HCl��Һ�μ�һ��ʱ����ҺpH>7
B������Һ��pH=8ʱ����Һ��NaHCO3�����ʵ���Ũ��Ϊ0.1mol��L��1
C��0.1 mol��L��1Na2CO3��Һ��c(Na+)+c(H+)=c(OH��)+2c(CO32��)+c(HCO3��)
D����M����c(Na+)>c(CO32��)=c(HCO3��)>c(OH��)>c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У��������ͼʾ������һ��������һ��ת����ϵ������У� ��
��� | X | Y | Z | W |
|
�� | Si | Na2SiO3 | H2SiO3 | SiO2 | |
�� | Na | NaOH | Na2CO3 | NaCl | |
�� | Cl2 | Ca(ClO)2 | HClO | HCl | |
�� | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.�ڢ�B.�٢ۢ�C.�٢�D.�٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£��ں����ܱ������з�����ӦNO2(g)��SO2(g) ![]() SO3(g)��NO(g����H= - 41.8 kJmol-1��������˵���÷�Ӧ�ﵽƽ��״̬����
SO3(g)��NO(g����H= - 41.8 kJmol-1��������˵���÷�Ӧ�ﵽƽ��״̬����
A.��H����ֵ���ٱ仯B.�����ڵ�ѹǿ���ٱ仯
C.�������ɫ���ٱ仯D.������ܶȱ��ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������ľ̿�����������ҹ��Ĵ���֮һ�ĺڻ�ҩ�䷽���ڻ�ҩ��ըʱ�����ķ�ӦΪS+2KNO3+3C ![]() K2S+N2��+3CO2�������ڸ÷�Ӧ˵������ȷ����
K2S+N2��+3CO2�������ڸ÷�Ӧ˵������ȷ����
A. ����������CO2
B. ��ը��ԭ���Ƿ�Ӧ�ͷŴ����ȣ������ɴ�������
C. ��Ӧ��������Ԫ�صĻ��ϼ۷����仯
D. �������뻹ԭ�������ʵ���֮��Ϊ1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ������Ҫ450 mL 0.5 mol/L��NaOH��Һ��500 mL 0.2 mol/L��H2SO4��Һ��
��ش��������⣺
��.����NaOH��Һ
��1�����ݼ��㣬��������ƽ��ȡNaOH���������ӦΪ_____g��
A.0.9B.9.0C.10D.10.0
��.����ϡH2SO4
ijͬѧ������������Ϊ98%��Ũ����(�ܶ���=1.84 g/cm3)���������ϡH2SO4���ɹ�ѡ�õ������У��ٽ�ͷ�ιܣ��ڲ����������ձ�������Ͳ����500 mL����ƿ����Բ����ƿ
��2�����������в���Ҫ����
A.��B.��C.��D.��
��3������Ͳ��ȡ����Ũ��������ӦΪ_______mL��
A.5.4B.5.5C.18.4D.27.2
��4�����ʵ������10 mL��20 mL��50 mL����Ͳ��Ӧѡ��_______mL��Ͳ��ȡ��
A.10B.20C.50D.���϶�����
��5�����в�����ʹ�����Ƶ���ҺŨ��ƫ�ߵ���
A.����ƿ��ԭ������������ˮδ������
B.����ʱ��������ƿ�̶���
C.����Ͳ��ȡŨ����ʱ���Ӷ���
D.����ʱ��������ˮ�����̶��ߣ����õιܽ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ���ɻ�ͭ����Ҫ�ɷ� CuFeS2����ȡ FeSO4��7H2O ��Cu����Ҫ�������£�

��1��������������� Fe2+�Ƿ�������Ӧѡ��________������ĸ��ţ���
A��KMnO4 ��Һ B��K3[Fe(CN)6]��Һ C��KSCN ��Һ
��2�������������Ҫ��Ӧ�Ļ�ѧ����ʽΪ__________��
��3��ijͬѧ��ʢ�� H2O2 ��Һ���Թ��м��뼸���ữ�� FeSO4 ��Һ����Һ����ػ�ɫ��������Ӧ�����ӷ���ʽΪ___________��һ��ʱ�����Һ�������ݳ��֣������ȣ�����к��ɫ�������ɣ��������ݵ�ԭ����_________�����ɳ�����ԭ����___________����ƽ���ƶ�ԭ�����ͣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ҺX�п��ܺ���NO3����Cl����SO42����CO32����NH4+��Fe2+��Fe3+�еļ����������������ӵ����ʵ�����ȡ�Ϊȷ������ҺX�ijɷ֣�ijѧϰС����������ʵ�飺

������˵����ȷ����
A. ������Fe3+����һ������Cl��
B. SO42����NH4+һ�����ڣ�Fe2+��Fe3+���ܶ�����
C. ����Һ��ֻ�������������е�NO3����SO42����NH4+��Fe2+��������
D. �������ʹʪ�����ɫʯ����ֽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ִ�Ĥ������ʹij�����Ӿ��е���ͨ������,�����ڵ��ء�ԭ����С����NaB(OH)4��Һ���Ʊ�H3BO3,�乤��ԭ����ͼ�����������������(����)
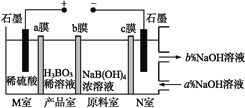
A. M�ҷ����ĵ缫��Ӧʽ:2H2O-4e-![]() O2��+4H+
O2��+4H+
B. N��:a<b
C. ��Ʒ�ҷ����ķ�Ӧ��B(OH)4- +H+![]() H3BO3+H2O
H3BO3+H2O
D. ������ÿ����1 mol��Ʒ,�����ҿ����ɱ�״����5.6 L����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com