
| A. | 甲硫醇(CH3SH)比甲醇(CH3OH)的熔点低的原因是甲醇分子间易形成氢键 | |
| B. | N-O键的极性比C-O键的极性小 | |
| C. | 氨易液化与氨分子间存在氢键有关 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
分析 A、甲醇中含有-OH,氢元素电负性很大,甲醇分子之间形成氢键,沸点较高;
B、原子半径大小与键能的大小有关;
C、氨气分子之间存在氢键,沸点相对较高,故氨气容易液化;
D、氢键影响物质的物理性质,水是非常稳定的化合物,是指水不易分解,属于化学性质,由分子内O-H决定.
解答 解:A、甲醇中含有-OH,氢元素电负性很大,甲醇分子之间形成氢键,沸点比甲硫醇(CH3SH)高,故A正确;
B、原子半径N<O,N-O键能较大,故B正确;
C、由于氨气分子之间存在氢键,氨气沸点相对较高,故氨气容易液化,故C正确;
D、氢键影响物质的物理性质,水是非常稳定的化合物,是指水不易分解,属于化学性质,由水分子内O-H决定,故D错误;
故选D.
点评 本题考查氢键及对物质性质的影响等,难度不大,注意常见形成氢键的元素,理解分子内氢键与分子间氢键的形成对物质性质的影响.


科目:高中化学 来源: 题型:选择题
| A. | Fe-2e-=2Fe2+ | B. | Fe-3e=Fe3+ | ||
| C. | 2H2O+O2+4e-=4OH- | D. | 4OH--4e-=2H2O+O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | ①②③⑤ | C. | ②③④⑥ | D. | 以上全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
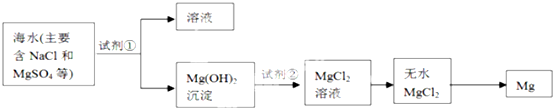
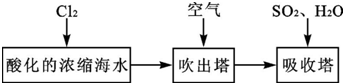
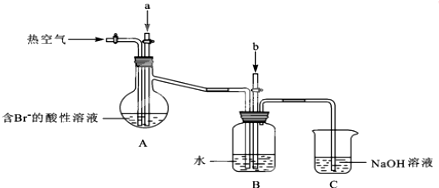
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CSO的电子式: | |
| B. | Cl-的结构示意图: | |
| C. | 甲烷分子的比例模型: | |
| D. | 原子核内有20个中子的氯原子:2017Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaSO4难溶于水,属于非电解质 | |
| B. | SO2能与碱反应生成盐和水,属于酸性氧化物 | |
| C. | NH4Cl组成中不含金属离子,不属于盐 | |
| D. | NaHSO4能电离出H+,NaHSO4属于盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 利用黄花蒿叶研究青蒿素结构的基本步骤为:分离、提纯→元素分析确定实验式→测定相对分子质量确定分子式→波谱分析确定结构式 | |
| B. | 双氢青蒿素在水中的溶解性大于青蒿素 | |
| C. | ①、②的反应类型分别为还原反应、取代反应 | |
| D. | 青蒿素转化为双氢青蒿素,手性碳个数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 L 0.1 mol•L-1 (NH4)2Fe(SO4)2•6H2O溶液中:c(NH4+)+c(Fe2+)+c(H+)=c(OH-)+c(SO42-) | |
| B. | 0.1 mol•L-1的NH4Cl与0.1 mol•L-1的NH3•H2O等体积混合:c(NH4+)+2c(H+)=c(NH3•H2O)+2c(OH-) | |
| C. | pH=9.4、浓度均为0.1 mol•L-1的HCN与NaCN的混合溶液中:c(Na+)>c(CN-)>c(HCN)>c(OH-) | |
| D. | 0.1 mol•L-1 CH3COONa 溶液与0.05 mol•L-1盐酸等体积混合后的酸性溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 生物质能是一种洁净、可再生能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.
生物质能是一种洁净、可再生能源.生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com