
| 3 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 4 |
| 1 |
| 4 |
| 3 |
| 4 |
| 1 |
| 4 |


科目:高中化学 来源: 题型:
| A、目前加碘食盐中主要添加的是KI |
| B、生理盐水的浓度为0.9% |
| C、淀粉、蛋白质、脂肪都是营养物质,都属于高分子化合物 |
| D、家庭可以用明矾将自来水净化成纯净水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、s电子绕核旋转,其轨道为一圆圈,而p电子是走∞字形 |
| B、s轨道都是球形轨道 |
| C、轨道不同,电子云的取向不一样 |
| D、电子云图是形象地描述电子在空间单位体积内出现概率大小的图形 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图.下列说法正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图.下列说法正确的是( )| A、元素Y与元素Z的最高正化合价之和的数值等于9 |
| B、离子Y2-和Z3+的核外电子数和电子层数都不相同 |
| C、原子半径的大小顺序为:rZ>rW>rQ>rX>rY |
| D、元素W的氢化物稳定性和还原性均比Q的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
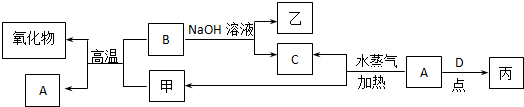
查看答案和解析>>
科目:高中化学 来源: 题型:
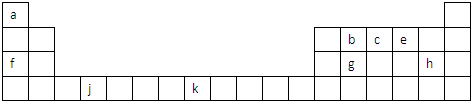
查看答案和解析>>
科目:高中化学 来源: 题型:
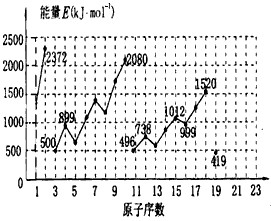
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ② |
| ③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com