
| A、c(Na+)=c(H2SO3)+c(HSO3-)+c (H+) |
| B、c(SO32-)+c(OH-)=c(H+)+c(H2SO3) |
| C、c(Na+)+c(H+)=c(HSO3-)+c(SO32-)+c(OH-) |
| D、c(Na+)>c(HSO3-)>c( OH-)>c(H2SO3)>c(SO32-)>c(H+) |
| 4.48L |
| 22.4L/mol |
| 4.48L |
| 22.4L/mol |


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 足量CH3COOH |
| ① |
| O2 |
| NaOH溶液△ |
| ② |
| H+ |
| 浓硫酸 |
| △ |

查看答案和解析>>
科目:高中化学 来源: 题型:

| 阴离子 Ksp 阳离子 | CO32- | F- | OH- |
| Ca2+ | 5.0×10-9 | 1.5×10-10 | 4.7×10-6 |
| Mg2+ | 3.8×10-6 | 7.4×10-11 | 5.6×10-12 |
| Mn2+ | 2.2×10-11 | 5.3×10-3 | 2.1×10-13 |
| Zn2+ | 1.2×10-10 | 3.0×10-2 | 6.9×10-17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Cl-、Na+、SiO32- | ||
B、Ba2+、NO
| ||
| C、K+、Na+、I-、SO42- | ||
D、Na+、Cu2+、NH3.H2O、SO
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、无色溶液中可能大量存在Cu2+、NH4+、Cl-、S2- |
| B、中性溶液中可能大量存在Fe3+、K+、Cl-、CO32- |
| C、酸性溶液中可能大量存在Na+、ClO-、SO42-、I- |
| D、弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用如图装置做如下实验.其中收集方法及所加试剂、现象、结论均正确的是
用如图装置做如下实验.其中收集方法及所加试剂、现象、结论均正确的是| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | SO2 | 酚酞、NaOH混合溶液 | 溶液红色消失 | SO2具有漂白性 |
| B | NH3 | 酚酞试液 | 溶液变红 | NH3的水溶液显碱性 |
| C | X | 澄清石灰水 | 溶液变浑浊 | X一定是CO2 |
| D | Cl2 | 淀粉、KI混合溶液 | 溶液变蓝色 | Cl2有氧化性 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 充电 |
| 放电 |

查看答案和解析>>
科目:高中化学 来源: 题型:
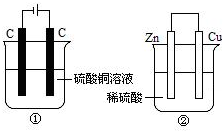 如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )
如图两个装置中,液体体积均为200mL,开始工作前电解质溶液的浓度均为0.5mol/L,工作一段时间后,测得有0.02mol电子通过,若忽略溶液体积的变化,下列叙述正确的是( )| A、产生气体体积 ①=② |
| B、①中阴极质量增加,②中正极质量减小 |
| C、溶液的pH变化:①减小,②增大 |
| D、电极反应式:①中阳极:4OH--4e-=2H2O+O2↑②中负极:2H++2e-=H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com