
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯,二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:
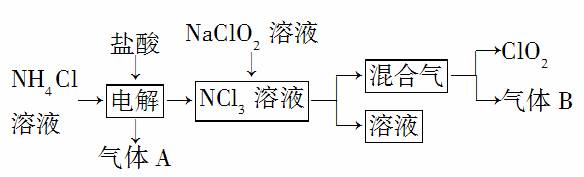
(1)ClO2中所有原子________(填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用________(填 选项字母)。
选项字母)。
A.饱和食盐水 B.碱石灰
C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是( )
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室区要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备,但该方法缺点是产率低、产物难以分离,还可能污染环境。写出该方法发生反应的化学方程式________________________。
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是______________________,此法相比欧洲方法的优点是___________________________________________________________。
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为
_______________________________________________________。
此法提高了生产及储存、运输的安全性,原因是______________________________________________________________。
解析 (1)ClO2中氯原子最外层有7个电子,是奇数,而两个氧原子最外层共有12个电子,是偶数,所以ClO2中所有原子并不是都满足8电子结构。能使石蕊试液显蓝色的气体是氨气,氨气是碱性气体,可用浓硫酸吸收。(2)由题目所给 信息知,二氧化氯可代替氯气用于工业和饮用水处理,是“绿色”消毒剂,A项正确。由于二氧化氯具有消毒杀菌的功效,所以应用在食品工业中能有效地延长食品贮藏期,B项正确。稳定性二氧化氯的出现大大增加了二氧化氯的使用范围,C项正确。二氧化氯是一种极易爆炸的强氧化性气体,故在工作区和成品储藏室区要有通风装置和监测及警报装置,D项正确。(3)根据“可能污染环境”可知反应中有氯气生成,根据得失电子守恒、元素守恒等配平化学方程式。(4)根据题目所给信息知,反应物为NaClO2和Cl2,产物中有ClO2,根据得失电子守恒和元素守恒知该反应的化学方程式为2NaClO2+Cl2===2NaCl+2ClO2。(5)该方法中生成的二氧化碳起到稀释作用,提高了生产、储存及运输的安全性。
信息知,二氧化氯可代替氯气用于工业和饮用水处理,是“绿色”消毒剂,A项正确。由于二氧化氯具有消毒杀菌的功效,所以应用在食品工业中能有效地延长食品贮藏期,B项正确。稳定性二氧化氯的出现大大增加了二氧化氯的使用范围,C项正确。二氧化氯是一种极易爆炸的强氧化性气体,故在工作区和成品储藏室区要有通风装置和监测及警报装置,D项正确。(3)根据“可能污染环境”可知反应中有氯气生成,根据得失电子守恒、元素守恒等配平化学方程式。(4)根据题目所给信息知,反应物为NaClO2和Cl2,产物中有ClO2,根据得失电子守恒和元素守恒知该反应的化学方程式为2NaClO2+Cl2===2NaCl+2ClO2。(5)该方法中生成的二氧化碳起到稀释作用,提高了生产、储存及运输的安全性。
答案 (1)不是 C
(2)ABCD
(3)2NaClO3+4HCl(浓)===2NaCl+Cl2↑+2ClO2↑+2H2O
(4)2NaClO2+Cl2===2NaCl+2ClO2 产率高,易于分离,没有产生毒副产品
(5)H2C2O4+2NaClO3+H2SO4===Na2SO4+2CO2↑+2ClO2↑+2H2O 反应过程中生成的二氧化碳起到稀释作用


科目:高中化学 来源: 题型:
当溶液中XO42- 和SO32- 的离子数之比为1∶2时,恰好完全发生氧化还原反应,X在还原产物中的化合价为 ( )
A、 +1 B、+2 C、+3 D、+4
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,0.01 mol·L-1 MOH溶液的pH为10。已知:2MOH(aq)+H2SO4(aq)===M2SO4(aq)+2H2O(l) ΔH1=-2 4.2 kJ·mol-1;H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为( )
4.2 kJ·mol-1;H+(aq)+OH-(aq)===H2O(l) ΔH2=-57.3 kJ·mol-1。则MOH在水溶液中电离的ΔH为( )
A.+33.1 kJ·mol-1 B.+45.2 kJ·mol-1
C.-81.5 kJ·mol-1 D.-33.1 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
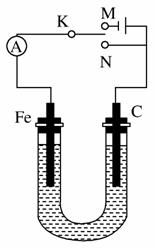
如图所示,用铁棒和石墨棒作电极电解1 L 1 mol/L的食盐水,下列有关说法正确的是( )
A.电键K与N连接,铁棒被保护而免受腐蚀
B.电键K与N连接,正极反应式为4OH--4e-===2H2O+O2↑
C.电键K与M连接,当两极共产生标准状况下气体33.6 L时,理论上生成1 mol NaOH
D.电键K与M连接,将石墨棒换成铜棒,就可实现在铁棒上镀铜
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。
请回答下列问题:
(1)Y基态原子的电子排布式是________;Z所在周期中第一电离能最大的主族元素是________。
(2)XY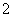 离子的立体构型是________;R2+的水合离子中,提供孤电子对的原子是________。
离子的立体构型是________;R2+的水合离子中,提供孤电子对的原子是________。
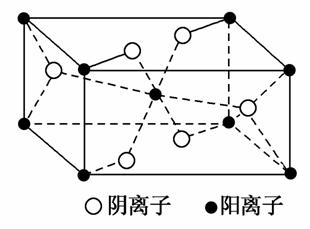
(3)Z与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是________。
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯化亚铜(CuCl)是白色粉末,微溶于水,不溶于乙醇,在空气中会被迅速氧化成绿色碱式盐。从酸性电镀废液(主要含Cu2+、Fe3+)中制备氯化亚铜的工艺流程图如下:
[已知:金属离子浓度为1 mol·L-1时,Fe(OH)3开始沉淀和沉淀完全的pH分别为1.4和3.0,Cu(OH)2开始沉淀和沉淀完全的pH分别为4.2和6.7]

(金属离子含量与混合液pH、CuCl产率与混合液pH的关系图)
请回答下列问题:
(1)酸浸时发生反应的离子方程式是______________________;析出CuCl晶体时的最佳pH在____左右。
(2)铁粉、氯化钠、硫酸铜在溶液中反应生成CuCl的离子反应方程式为________________________________________________________________________。
(3)析出的CuCl晶体要立即用无水乙醇洗涤,在真空干燥机内于70 ℃干燥2小时、冷却,密封包装。70 ℃真空干燥、密封包装的目的是_____________________________________________________________。
(4)产品滤出时所得滤液的主要成分是________________,若想从滤液中获取FeSO4·7H2O晶体,我们还需要知道的是_____________________。
(5)若将铁粉换成亚硫酸钠也可得到氯化亚铜,试写出该反应的化学方程式________________________________________________。为提高CuCl的产率,常在该反应体系中加入稀碱溶液,调节pH至3.5。这样做的目的是__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式表达正确的是( )
A.氢氧化铁溶于氢碘酸:Fe(OH)3+3H+===Fe3++3H2O
B.小苏打溶液呈碱性的原因:HCO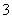 +H2OH3O++CO
+H2OH3O++CO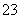
C.溴化亚铁溶液中通入足量氯气:2Fe2++4Br-+3Cl2===2Fe3++2Br2+6Cl-
D.向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH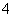 +Al3++2SO
+Al3++2SO +2Ba2++5OH-===AlO
+2Ba2++5OH-===AlO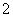 +2BaSO4↓+NH3·H2O+2H2O
+2BaSO4↓+NH3·H2O+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
观察下图中物质分子的比例模型及其变化,请回答下列问题:
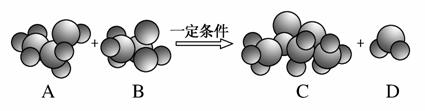
(1)A是乙醇,则B、C的结构简式分别为__________________、__________________。
(2)上图所示化学方程式中的“一定条件”是________________________________________________________________________。
(3)反应物中只有乙醇分子中的氧原子是18O,生成物中含这种氧原子的是(写物质名称)________。
(4)在B的分子中,最外层电子数为8的原子有________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
为除去MgCl2酸性溶液中的Fe3+,可在加热搅拌的条件下加入一种试剂,过滤后,向滤液中加入适量盐酸,这种试剂是 ( )
A.NH3·H2O B.NaOH
C.Na2CO3 D.MgCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com