
| 元素 | 相关信息 |
| X | 其一种同位素,可被用作相对原子质量的标准 |
| Y | 其最高价氧化物对应水化物能与其气态氢化物相互间发生化合反应 |
| P | 是短周期中(除稀有气体外)原子半径最大的元素 |
| Q | 存在质量数为25,中子数为13的核素 |
| W | 位于周期表第13列 |
| R | 与Z同族,且最高价氧化物对应水化物的浓溶液常温下与W单质会出现钝化现象 |
| 化合物 | X3Y4 | R2T2 |
| 晶体类型 | ||
| 熔点/℃ | >3600 | -76 |
 ,用化学方程式表示P2R溶液在空气中的变质过程4Na2S+O2+2H2O═4NaOH+2Na2S2.
,用化学方程式表示P2R溶液在空气中的变质过程4Na2S+O2+2H2O═4NaOH+2Na2S2. 分析 元素周期表短周期中的常见主族元素中,X元素的一种同位素可被用作相对原子质量的标准,则X为C元素;Y元素的最高价氧化物对应水化物能与其气态氢化物相互间发生化合反应,则Y为N元素;P是短周期中(除稀有气体外)原子半径最大的元素,则P为Na;Q存在质量数为25,中子数为13的核素,其质子数为25-13=12,则Q为Mg;W位于周期表第13列,原子序数大于Mg,故W为Al;R与Z同族,且最高价氧化物对应水化物的浓溶液常温下与W单质(Al)会出现钝化现象,则R为S元素,Z为O元素;T的原子序数最大,则T为Cl.
解答 解:元素周期表短周期中的常见主族元素中,X元素的一种同位素可被用作相对原子质量的标准,则X为C元素;Y元素的最高价氧化物对应水化物能与其气态氢化物相互间发生化合反应,则Y为N元素;P是短周期中(除稀有气体外)原子半径最大的元素,则P为Na;Q存在质量数为25,中子数为13的核素,其质子数为25-13=12,则Q为Mg;W位于周期表第13列,原子序数大于Mg,故W为Al;R与Z同族,且最高价氧化物对应水化物的浓溶液常温下与W单质(Al)会出现钝化现象,则R为S元素,Z为O元素;T的原子序数最大,则T为Cl.
(1)R为S元素,在元素周期表中的位置为第三周期VIA族,Q、W、Z、Y的简单离子分别为Mg2+、Al3+、O2-、N3-,电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:N3->O2->Mg2+>Al3+,
故答案为:第三周期VIA族;N3->O2->Mg2+>Al3+;
(2)Cl2、CCl4均为非极性分子,相似相溶,氯气易溶于四氯化碳中,
故答案为:Cl2、CCl4均为非极性分子,相似相溶;
(3)X3Y4的熔点高于3600℃,熔点很高,属于原子晶体,R2T2的熔点为-76℃,熔点很低,属于分子晶体,
故答案为:原子晶体;分子晶体;
(4)任意一个由N、O元素分别与氢元素形成的10电子粒子间相互反应的离子方程式:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(5)13.5g Al 的物质的量为$\frac{13.5g}{27g/mol}$=0.5mol,在氧气中燃烧放热419KJ,则1molAl燃烧放热为419kJ×2=838KJ,燃烧热的热化学方程式为:Al(s)+$\frac{3}{2}$O2(g)=$\frac{1}{2}$Al2O3(s)△H=-838kJ/mol;
故答案为:Al(s)+$\frac{3}{2}$O2(g)=$\frac{1}{2}$Al2O3(s)△H=-838kJ/mol;
(6)化合物Na2S溶液在空气中长期放置,与氧气反应会生成Na2S2,与过氧化钠的结构相似,则Na2S2的电子式为 ,Na2S溶液在空气中变质过程的化学方程式为:4Na2S+O2+2H2O═4NaOH+2Na2S2,
,Na2S溶液在空气中变质过程的化学方程式为:4Na2S+O2+2H2O═4NaOH+2Na2S2,
故答案为: ;4Na2S+O2+2H2O═4NaOH+2Na2S2.
;4Na2S+O2+2H2O═4NaOH+2Na2S2.
点评 本题以元素推断为载体,考查微粒半径比较、分子结构与性质、晶体类型与性质、热化学方程式书写、信息获取与知识迁移运用等,是对学生综合能力的考查,需要学生具备扎实的基础与灵活运用能力.


科目:高中化学 来源: 题型:选择题
| A. | 通入足量溴水中 | B. | 在空气中燃烧 | ||
| C. | 通入酸性高锰酸钾溶液中 | D. | 通入水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
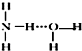 …”表示)结合成NH3•H2O分子,根据氨水的性质可知NH3•H2O的结构式为
…”表示)结合成NH3•H2O分子,根据氨水的性质可知NH3•H2O的结构式为| A. | ②⑥ | B. | ①②⑥ | C. | ②⑤⑥⑧ | D. | ③④⑥⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 装置甲:测定一定时间内生成H2的速率 | |
| B. | 装置乙:萃取碘水中的碘 | |
| C. | 装置丙:海水蒸馏得淡水 | |
| D. | 装置丁:测定中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  能催化氧化生成醛 能催化氧化生成醛 | |
| B. | 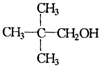 能在浓硫酸的作用下生成烯 能在浓硫酸的作用下生成烯 | |
| C. | CH3Br 能在氢氧化钠的乙醇溶液的作用下生成醇 | |
| D. | 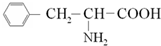 既能与酸反应也能与碱反应生成盐 既能与酸反应也能与碱反应生成盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
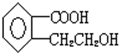
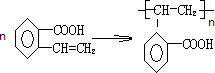 ,加聚反应.
,加聚反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液可作外伤止血剂,其原理与胶体知识有关 | |
| B. | C单质可在高温下被浓H2SO4和浓HNO3氧化,而Si 单质不与任何酸反应 | |
| C. | SiO2 分子的空间构型为四面体空间网状结构,因此SiO2晶体硬度大,熔沸点高 | |
| D. | 标准状况下,22.4LSO2和SO3的混合物所含分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 重水的分子式是H218O | B. | 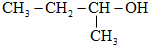 的系统命名为1-甲基-1-丙醇 的系统命名为1-甲基-1-丙醇 | ||
| C. | 氯乙烷官能团的结构式Cl | D. | 次氯酸的电子式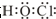 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com