
����Ŀ��G��һ�����������м��壬ij�ֺϳ�·�����£�
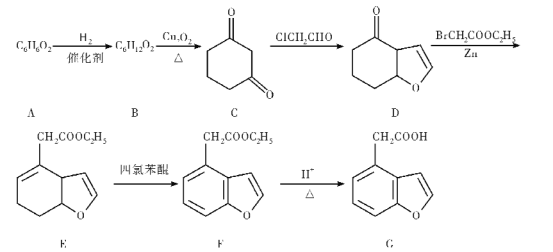
��������ת����ϵ���ش��������⣺
��1�������廯����A��������___��
��2��D�����������ŵ�������____��
��3��B��C�ķ�Ӧ����ʽΪ____��
��4��F��G�ķ�Ӧ����___��
��5��G��ͬ���칹����ͬʱ�������������Ĺ���____�֣����������칹����
�ٷ����廯������ܷ���������Ӧ����ֻ��һ�ֹ����ţ����У��˴Ź���������ʾΪ4��壬�ҷ������Ϊ1��2��2��3����__��д��һ�ֽṹ��ʽ����
��6�����������ϳ�·�ߣ�д����![]() ��BrCH2COOC2H5Ϊԭ�ϣ����Լ���ѡ�����Ʊ�
��BrCH2COOC2H5Ϊԭ�ϣ����Լ���ѡ�����Ʊ�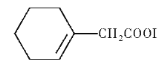 �ĺϳ�·��____________��
�ĺϳ�·��____________��
���𰸡��䱽���ӻ�1��3-������ �ʻ����Ѽ���̼̼˫�� 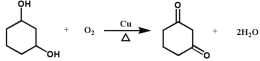 ȡ����Ӧ 16��
ȡ����Ӧ 16�� 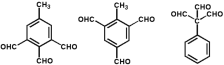

��������
��C�Ľṹ��ʽ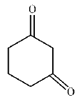 ��
�� ����֪BΪ
����֪BΪ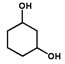 ��AΪ
��AΪ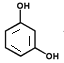 ���ٽ�����������ʵĽṹ��ʽ�ͷ�Ӧ���������ƶϡ�
���ٽ�����������ʵĽṹ��ʽ�ͷ�Ӧ���������ƶϡ�
��1����������������֪�����廯����A�������Ǽ䱽���ӻ�1��3-�����ӡ��𰸣��䱽���ӻ�1��3-�����ӡ�
��2����D�Ľṹ��ʽ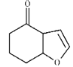 ��֪���������ŵ��������ʻ����Ѽ���̼̼˫�����𰸣��ʻ����Ѽ���̼̼˫����
��֪���������ŵ��������ʻ����Ѽ���̼̼˫�����𰸣��ʻ����Ѽ���̼̼˫����
��3��B�Ľṹ��ʽΪ ��C�Ľṹ��ʽΪ
��C�Ľṹ��ʽΪ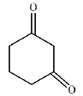 ����Ӧ����B
����Ӧ����B![]() C���䷽��ʽΪ
C���䷽��ʽΪ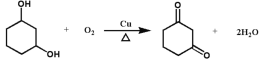 ���𰸣�
���𰸣� ��
��
��4����F��G�Ľṹ��ʽ������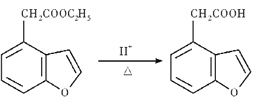 ��֪�÷�Ӧ����Ϊ������ˮ�ⷴӦ��Ҳ�ɳ�Ϊȡ����Ӧ���𰸣�ȡ����Ӧ��
��֪�÷�Ӧ����Ϊ������ˮ�ⷴӦ��Ҳ�ɳ�Ϊȡ����Ӧ���𰸣�ȡ����Ӧ��
��5��G�Ľṹ��ʽΪ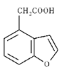 ��ͬʱ����ٷ����廯����˵�����б��������ܷ���������Ӧ����ֻ��һ�ֹ����ţ�˵������ȩ������������G��ͬ���칹����
��ͬʱ����ٷ����廯����˵�����б��������ܷ���������Ӧ����ֻ��һ�ֹ����ţ�˵������ȩ������������G��ͬ���칹����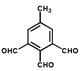 ���ƶ�-CH3��2�֣���
���ƶ�-CH3��2�֣���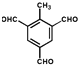 ����-CH3��-CHO��4�֣���
����-CH3��-CHO��4�֣���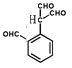 ��3�֣�,
��3�֣�,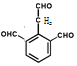 (6��)��
(6��)��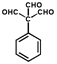 ������16�֣����У��˴Ź���������ʾΪ4��壬�ҷ������Ϊ1��2��2��3����
������16�֣����У��˴Ź���������ʾΪ4��壬�ҷ������Ϊ1��2��2��3����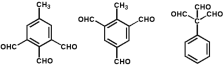 ���𰸣�16��
���𰸣�16�� ��
��


 ǧ�������������ĩ�����Ծ�����ϵ�д�
ǧ�������������ĩ�����Ծ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�����ڹ�ũҵ�����о��й㷺Ӧ�ã���ش��������⣺
��1����̬��ԭ�ӵĺ�������Ų�ʽΪ__________������Ԫ�����ڱ��е�_____��Ԫ�ء�
��2��Cr3�����γ�������[Cr(H2O)��H2NCH2CH2NH2��]3�����ڸ���������C��N��O�ĵ�һ�������ɴ�С��˳��Ϊ_________�� ������H2NCH2CH2NH2�в���sp3�ӻ���ԭ����__________��
��3���Ȼ�������CrO2Cl2���۵㣺-96.5�棬�е㣺117�棬����CS2�Ȼ��ܣ����̬CrO2Cl2����_______���塣��֪NO2����CS2��Ϊ�ȵ����壬��1molNO2���к��Цм���ĿΪ_________��
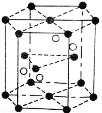
��4��Cr2O3�����ṹ��ͼ��ʾ����֪Cr2O3��Ħ������ΪMg/mol,������ܶ�Ϊ��g��cm��3 ���������ΪVcm3. �����ṹʾ��ͼ�е�С�������__________��������ӡ��������ӡ����������ӵ�����NA= _______mol-1(�ú�M, V, �ѵĴ���ʽ��ʾ ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������δ���dz�������Դ����ѧ��������Ƴ�����̫���ܲ������⣬���ڶ�������(TiO2)��������ʹ��ˮ�ֽ�õ��������¼�����2H2O![]() 2H2+O2���Ƶõ�����������ȼ�ϵ� �ء��ϳɰ���ҵ���ش��������⣺
2H2+O2���Ƶõ�����������ȼ�ϵ� �ء��ϳɰ���ҵ���ش��������⣺
(1)�ֽ⺣ˮʱ��__________��ת��Ϊ_______________�ܡ����ɵ���������ȼ�ϵ��ʱ��___________��ת�� Ϊ_____�ܡ�
(2)���������ںϳɰ���һ���¶��£���2L���ܱ������м���1 molN2��3molH2 ������ӦN2(g)+3H2(g)![]() 2NH3(g)��2minʱ���N2��Ũ��Ϊ0.3mol/L��5minʱ�ﵽƽ�⣬��ʱ���ѹǿΪ��ʼʱ��
2NH3(g)��2minʱ���N2��Ũ��Ϊ0.3mol/L��5minʱ�ﵽƽ�⣬��ʱ���ѹǿΪ��ʼʱ��![]() ����ǰ2min��NH3��ʾ�Ļ�ѧ��Ӧ����Ϊ__________��ƽ��ʱ��N2��ת����Ϊ_________��
����ǰ2min��NH3��ʾ�Ļ�ѧ��Ӧ����Ϊ__________��ƽ��ʱ��N2��ת����Ϊ_________��
(3)�ϳɰ�����Ҫ�����ĵ���Ϊԭ�ϣ���ҵ�ϻ�ô��������ķ�����____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����V L����Na2SO4��MgSO4�Ļ����Һ�ֳ����ȷݣ�һ�ݼ��뺬a mol KOH����Һ��ǡ��ʹþ������ȫ����Ϊ������þ����һ�ݼ��뺬b mol BaCl2����Һ��ǡ��ʹ�����������ȫ����Ϊ���ᱵ����ԭ�����Һ�������ӵ�Ũ��Ϊ( )
A.2(2b-a)/V mol/LB.2(b-a)/V mol/LC.(2b-a)/V mol/LD.(b-a)/V mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����0.1mol��L-1NaA��Һ����εμ����ᣬ��û����Һ��pH��p![]() �仯��ϵ��ͼ��ʾ[
�仯��ϵ��ͼ��ʾ[![]() =-lg
=-lg![]() ]������˵����ȷ����
]������˵����ȷ����
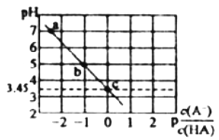
A. a����Һ��c��Na+��=c��A-��
B. ���볣��K��HA����������Ϊ10-4
C. �μӹ�����![]() ���ϼ�С
���ϼ�С
D. b����Һ��c��HA����c��Na+����c��A-����c��OH-��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E�����ʵĹ�ϵ����ͼ��ʾ��

��֪��X��ʹʪ��ĺ�ɫʯ����ֽ������
(1)��ɫҺ��A��_____��A��B��Ӧ�Ļ�ѧ����ʽ��____________��
(2)��Xת��ΪN2�Ļ�ѧ����ʽΪ______________��
(3)��ɫ����C�Ļ�ѧʽΪ��_____����Dת��ΪE�����ӷ���ʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������°�V�����������1���ˮ�еõ����ı�����Һ�������������ա�
(1)NH3ͨ��ˮ�з����ķ�ӦΪ____________________��
(2)��ˮ�д��ڵķ�����__________________________��
(3)��ˮ�д��ڵ�������__________________________��
(4)���ð�ˮ����������Ϊ________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���УĿǰ�����о�һ��ϡ��������ϣ�����Ҫ�ɷ���LaCaMnO��
(1)��ԭ�ӵĻ�̬�۲�����Ų�ʽΪ__.
(2)S��OΪͬ����Ԫ�أ����е縺�Խϴ����__�� H2S������Sԭ���ӻ��������Ϊ__���Դӽṹ�ǶȽ���H2SO4�����Դ���H2SO3�����ԣ�__��
(3)�ݱ�����Ca�ڿ����е�ȼ����CaO������Ca2N2��
��Ca2N2��ˮ��Ӧ����NH2��NH2��NH2��NH2�ܷ������壿__(����������������)
��CaO�γɵľ�����NaCl����һ����Ϊ�����������ܶѻ�����һ��CaO�����к� ��Ca2+��Ϊ__�����Ƚ�CaO��NaCl�ľ����ܴ�С���迼�ǵ�������__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)����VSEPR�ƶϷ��ӻ����ӵĿռ乹�͡�
PO![]() __________��CS2____________��AlBr3(���۷���)__________��
__________��CS2____________��AlBr3(���۷���)__________��
(2)�����ֻ��Է�Ӧ�м������ӣ����ǵ������о�����1��̼ԭ�Ӻ�3����ԭ�ӡ�������������������������ӵ����ģ�ͣ�д����Ӧ�Ļ�ѧʽ��
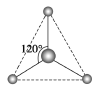 ______________��
______________��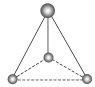 ______________��
______________��
(3)��Ҫ��д���ڶ����ڷǽ���Ԫ�ع��ɵ����Է��ӵĻ�ѧʽ��
ƽ�������η���________�������η���________���������η���________��
(4)Ϊ�˽��ͺ�Ԥ����ӵĿռ乹�ͣ���ѧ���ڹ�����������֪�ķ��ӿռ乹�͵Ļ����ϣ������һ��ʮ�ּ�����ģ�͡����۲���ӶԻ���ģ�͡�����ģ�Ͱѷ��ӷֳ����ࣺһ����____________________����һ����____________________��
BF3��NF3�����ĸ�ԭ�ӵķ��ӣ�BF3������ԭ����________��NF3������ԭ����________��BF3���ӵ����幹����ƽ�������ζ�NF3���ӵ����幹���������ε�ԭ����____________________________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com