
| A. | 原子核外电子排布--元素在周期表中的位置 | |
| B. | 弱电解质的相对强弱--电离常数的大小 | |
| C. | 分子间作用力的大小--分子稳定性的高低 | |
| D. | 物质内部储存的能量--化学反应的热效应 |
分析 A、元素在周期表中呈现规律性的变化与其核外电子排布有关;
B、电离常数越大说明该弱电解质越易电离;
C、稳定性与化学键有关,分子间作用力决定物质的物理性质;
D、物质内部储存的能量即键能,断开化学键与形成化学键决定化学反应的热效应.
解答 解:A、因为原子核外电子排布呈现规律性的变化,故元素在周期表中的位置也呈现规律性的变化,即原子核外电子排布决定了元素在周期表中的位置,故A正确;
B、相同类型的弱电解质,其电离常数越大说明该弱电解质越易电离,故B正确;
C、稳定性与化学键有关,分子间作用力决定物质的物理性质,则分子晶体的稳定性决定于其中的化学键,故C错误;
D、反应物的总能量大于生成物的总能量,则反应放热,否则吸热,即物质内部储存的能量决定了化学反应的热效应,故D正确,
故选C.
点评 本题主要考查的是元素周期表的形成、弱电解质的电离与电离常数、反应热效应等,综合性较强,有一定难度.


科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液 | B. | AgNO3溶液 | C. | Ba(OH)2溶液 | D. | BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3个 | B. | 4个 | C. | 5个 | D. | 6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
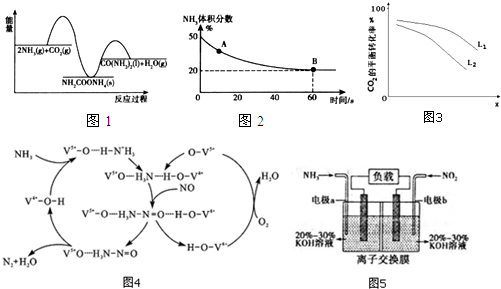
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 时间(s)n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) | 0.40 | a | 0.20 | c | d | e |
| n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
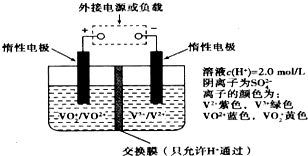 在能源和环保的压力下,新能源电动汽车无疑将成为未来汽车的发展方向.如果电动汽车上使用新型钒电池,一次性充电3-5分钟后,续航能力可达1000公里;而成本造价只有目前锂电池的40%,体积和重量分别是锂电池的$\frac{1}{25}$和$\frac{1}{10}$.全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示:下列有关该钒电池的说法不正确的是( )
在能源和环保的压力下,新能源电动汽车无疑将成为未来汽车的发展方向.如果电动汽车上使用新型钒电池,一次性充电3-5分钟后,续航能力可达1000公里;而成本造价只有目前锂电池的40%,体积和重量分别是锂电池的$\frac{1}{25}$和$\frac{1}{10}$.全钒液流储能电池是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置,其原理如图所示:下列有关该钒电池的说法不正确的是( )| A. | 充电过程中,H+可以通过质子交换膜向右移动,形成电流通路,并且参与电极反应 | |
| B. | 放电过程中,右槽溶液中溶液颜色由紫色变为绿色 | |
| C. | 该电池为可逆电池,当左槽溶液逐渐由黄变蓝时,为充电过程,此时左槽溶液pH值升高 | |
| D. | 充电时若转移的电子数为3.01×1023个,左槽溶液中n(H+)增加了0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
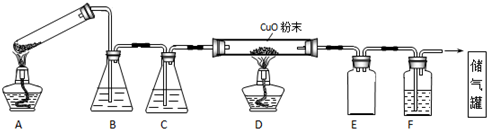
| 试管 | 0.01mol/L KMnO4 | 0.1mol/L H2C2O4 | 0.1mol/L H2SO4 | MnSO4固体 |
| 甲 | 4mL | x mL | 1mL | 无 |
| 乙 | y mL | 2mL | 1mL | 有 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com