
在密闭容器中进行反应N2+O2 2NO,下列条件能加快反应速率的是( )
2NO,下列条件能加快反应速率的是( )
A.增大体积使压强减小 B.体积不变,充入N2使压强增大
C.体积不变,充入He使压强增大 D.压强不变,充入气体Ne
科目:高中化学 来源:2016-2017学年河北省高一上学期期中化学试卷(解析版) 题型:选择题
用氯气消毒的自来水配制下列溶液时,会使配制的溶液变质的是( )
①NaOH ②AgNO3 ③Na2CO3 ④ FeCl2
A.只有②④ B.只有④ C.只有② D.全部
查看答案和解析>>
科目:高中化学 来源:2015-2016学年甘肃省白银市高二上期中化学试卷(解析版) 题型:选择题
在密闭容器中进行如下反应:X2(g)+Y2(g)  2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A.Z为0.3mol/L B.Y2为0.4mol/L C.X2为0.2mol/L D.Z为0.4mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:填空题
煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g)+H2O(g) H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
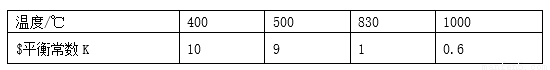
试回答下列问题:
(1)上述反应平衡常数的表达式为_____________,正反应是___________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率_________(填“增大”“减小”或“不变”),容器内混合气体的压强______________(填“增大”“减小”或“不变”)。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反 应方向进行的有______________(选填字母)。
应方向进行的有______________(选填字母)。

(4)830 ℃时,在2 L的密闭容器中加入4 mol CO(g )和6 mol H2O(g)达到平衡时,CO的转化率是________。
)和6 mol H2O(g)达到平衡时,CO的转化率是________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
已知H—H键的键能为436 kJ/mol,O=O键的键能为498 kJ/mol,根据热化学方程式H2(g)+  O2(g) =H2O( l ) ΔH=-286 kJ/mol,判断H2O分子中O—H键的键能为( )
O2(g) =H2O( l ) ΔH=-286 kJ/mol,判断H2O分子中O—H键的键能为( )
A.485.5 kJ/mol B.610 kJ/mol C.917 kJ/mol D.1220 kJ/mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
甲、乙两容器中都在进行A  B+C的反应,甲中每分钟减少4 mol A,乙中每分钟减少2 mol A,则甲、乙两容器中的反应速率的比较是( )
B+C的反应,甲中每分钟减少4 mol A,乙中每分钟减少2 mol A,则甲、乙两容器中的反应速率的比较是( )
A.甲快 B.乙快 C.无法确定 D.相等
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:计算题
实验室常用盐酸的质量分数为36.5%,密度为1.20g/㎝3。
(1)此浓盐酸的物质的量浓度是 ?(列式计算)
(2)配制100mL3.00mol/L的盐酸,需以上浓盐酸 mL.(列式计算)
(3)还原4.8g金属氧化物,参加反应的氢气为2.016L(标准状况),生成的金属溶于上述盐酸,放出氢气1.344 L(标准状况),此金属氧化物是 。
A.Fe2O3 B.ZnO C.CuO
(4)将5.0 g CaCO3加入到足量的盐酸中,并将生成的气体全部通入足量的红热的碳中充分反应,可得到气体的体积为 。(折算成标况下)
(5)某金属R与一定体积的上述盐酸正好完全反应所得氯化物溶液20 mL,浓度为0.05 mol/L。它恰好能与20 mL 0.15 mol·L-1 的AgNO3溶液完全反应,则该氯化物的化学式 .
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高一上10月阶段测化学卷(解析版) 题型:选择题
下列实验操作的描述中,正确的是 ( )
A. 取用Na2CO3溶液时,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B. 用溶解、过滤的方法分离氯化钠和硝酸钾的混合物
C. 称量NaOH固体,先在天平两盘上放大小相等纸片,然后NaOH放在左盘纸片上称量
D. 利用丁达尔效应可以区别溶液和胶体
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高一上学期期中化学试卷(解析版) 题型:选择题
将标准状况下的a L氨气溶于1000 g水中,得到氨水的密度为b g·cm-3,则该氨水的物质的量浓度为
A.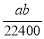 mol·L-1 B.
mol·L-1 B.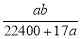 mol·L-1
mol·L-1
C.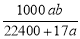 mol·L-1 D.
mol·L-1 D. mol·L-1
mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com