
【题目】某校化学小组学生利用如图所示装置进行“铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。
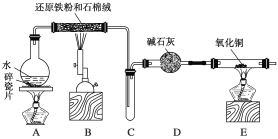
(1)装置B中发生反应的化学方程式是_________________________。
(2)装置E中的现象是_________________________________________。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中Fe3+的操作方法:________________________________________。
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下
![]()
步骤Ⅰ中加入新制氯水的作用是__________________________________。
【答案】3Fe+4H2O(g)![]() Fe3O4+4H2 黑色固体变红,右端管壁有水珠生成 取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色 将Fe2+氧化成Fe3+
Fe3O4+4H2 黑色固体变红,右端管壁有水珠生成 取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色 将Fe2+氧化成Fe3+
【解析】
(1)铁与水蒸气高温下反应生成四氧化三铁和氢气,写出反应的化学方程式;
(2)装置E中黑色的氧化铜被氢气还原成红色的铜,同时有水珠生成;
(3)根据三价铁的检验方法加KSCN溶液,观察是否变红;
(4)根据流程结合氯气的强氧化性分析氯气的作用;
(1)装置B中铁粉与水蒸气在高温下发生反应生成四氧化三铁和氢气,反应的化学方程式为:3Fe+4H2O(g)![]() Fe3O4+H2;
Fe3O4+H2;
(2)装置B铁与水蒸气反应生成的氢气,经碱石灰干燥后加入装置E,氧化铜与氢气加热发生反应生成了铜和水,所以反应的现象为:黑色的粉末变成红色,管壁产生水珠;
(3)检验三价铁用KSCN溶液,观察是否变红,故操作为:取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色;
(4)因为氯气具有强氧化性,所以能将二价铁离子氧化为三价铁离子,即为:将Fe2+氧化成Fe3+;


科目:高中化学 来源: 题型:
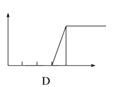
【题目】某学生在实验室做了4个实验:将对应图象的序号写在实验变化情况后的横线上:
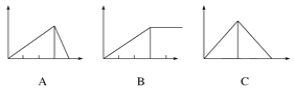
(1)向AlCl3溶液中逐滴加入稀氨水直至过量,沉淀的质量随氨水加入量的变化情况 ______,并写出相关的离子方程式_____________.
(2)向AlCl3溶液中逐滴加入NaOH溶液直至过量,沉淀的质量随NaOH溶液加入量的变化情况________,写出AlCl3溶液与过量NaOH溶液的离子方程式____________.
(3)向澄清石灰水中通入CO2直至过量,沉淀质量随CO2通入量的变化情况 _____ .
(4)向NaOH溶液中逐滴加入AlCl3溶液至过量,沉淀质量随AlCl3加入量的变化情况________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把200mL含有BaCl2和KCl的混合溶液分成2等份,一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则该混合溶液中钾离子浓度为( )
A.0.1(b-2a)B.10(2a-b)C.10(b-a)D.10(b-2a)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是
A.将饱和FeCl3溶液滴入沸水中:Fe3++3H2O![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
B.向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+SO42-+H+ =BaSO4↓+H2O
C.碳酸氢钠溶液中加入稀盐酸:CO32-+2H+ =CO2↑+H2O
D.铝与CuSO4溶液反应:Al+Cu2+=Cu+Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将3.48g四氧化三铁完全溶解在100mL 1mol/L的硫酸中,然后加入K2Cr2O7溶液25 mL恰好使溶液中的Fe2+全部转化为Fe3+,Cr2O72-全部转化为Cr3+,则K2Cr2O7溶液的物质的量浓度是( )
A. 0.05mol/L B. 0.2 mol/L C. 0.1 mol/L D. 0.3 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室进行二氧化硫制备与性质实验的组合装置如图所示,部分夹持装置未画出。

请回答下列问题:
(1)在组装好装置后,首先要进行的实验操作为_________________________________。
(2)为检验SO2与Na2O2的反应是否有氧气生成,装置B中盛放的试剂X应为________,装置D中碱石灰的作用是_______________________________________________。
(3)关闭弹簧夹2,打开弹簧夹1,注入70%的硫酸至浸没三颈烧瓶中的固体,检验SO2与Na2O2反应是否有氧气生成的操作及现象是_____________________________________。
(4)关闭弹簧夹1,打开弹簧夹2,残余气体进入装置E、F、G中,能说明I-的还原性弱于SO2的现象为_________________。发生反应的离子方程式是______________________。
(5)为了验证装置E中SO2与FeCl3发生了氧化还原反应,某学生设计了如下实验:取少量装置E中的溶液于试管中,向其中加入稀硝酸酸化的BaCl2溶液,产生白色沉淀,并由此判断SO2与FeCl3发生了氧化还原反应。上述方案是否合理?________(填“合理”或“不合理”),原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100 mL H2SO4和CuSO4的混合液中,用石墨作电极进行电解,两极上均收集到2.24 L气体(标准状况下),则原混合液中Cu2+的物质的量浓度为( )
A. 1 mol·L-1 B. 2 mol·L-1 C. 3 mol·L-1 D. 4 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C1O2是常用的自来水消毒剂。
I.已知实验室可用亚氯酸钠固体与氯气反应制备ClO2:2NaClO2+C12 =2C1O2+2NaCl,装置如下图所示:

(1)圆底烧瓶内发生反应的化学方程式是:__________。
(2)已知常温常压下,ClO2和Cl2是气体,在下列溶剂中溶解性如下表所示:
ClO2 | Cl2 | |
水 | 极易溶于水 | 溶 |
CCl4 | 难溶 | 溶 |
B、C、E装置中的试剂依次是_________(填序号)。
a.NaOH溶液 b.浓硫酸 c.饱和食盐水 d.CCl4 e.饱和石灰水
II.使用C1O2在给自来水消毒的过程中会产生有害的副产物亚氯酸根(ClO2-),可用Fe2+将其去除。已知ClO2-与Fe2+在pH=5~7的条件下能快速反应,最终形成红褐色沉淀,而ClO2-则被还原成Cl-。
(3)Fe2+消除ClO2-的离子方程式为_______。
(4)实际向自来水中加入Fe2+的量要高于理论值,原因是(结合离子方程式解释)___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四元轴烯t,苯乙烯b及立方烷c的结构简式如下,下列说法正确的是
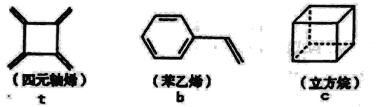
A.b的同分异构体只有t和c两种B.t和b能使酸性KMnO4溶液褪色而c不能
C.t、b、c的二氯代物均只有三种D.b中所有原子-定不在同-个平面上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com