
| 催化剂 | 氯化铁 | 二氧化锰 | 猪肝 | 马铃薯 |
| 压强对时间的斜率 | 0.0605 | 3.8214 | 0.3981 | 0.0049 |
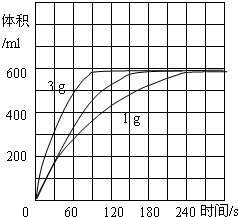
| H2O2 时间 FeCl36H2O |
1g | 2g | 3g |
| 3.0%(质量分数) 6.0%(质量分数) 9.0%(质量分数) |
445s 620s 790s |
135s 220s 300s |
110s 200s 230s |

 ,
, ;
;

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | ||||||||||||||
| i | |||||||||||||||||
| j | |||||||||||||||||

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2++2HCO3-+Ca2++2OH-=MgCO3↓+CaCO3↓+2H2O |
| B、Cu2++H2S=Cu S↓+2H+ |
| C、Zn2++S2-+2H2O=Zn(OH)2↓+H2S↑ |
| D、FeS+2H+=Fe2++H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质.为了测定该产品中碳酸钠的纯度,进行了以下实验:取16.5g纯碱样品放人烧杯中,将烧杯放在电子称上,再把0.0g稀盐酸(足量)加入样品中.观察读数变化如下表所示:
某化工集团用氨碱法生产的纯碱中含有少量氯化钠杂质.为了测定该产品中碳酸钠的纯度,进行了以下实验:取16.5g纯碱样品放人烧杯中,将烧杯放在电子称上,再把0.0g稀盐酸(足量)加入样品中.观察读数变化如下表所示:| 时间/s | 0 | 5 | 10 | 15 |
| 读数/g | 215.2 | 211.4 | 208.6 | 208.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 |
KClO3(g) | 氧化物 | 产生气体(mL) (已折算为标况) |
耗时(s) | ||
| 化学式 | 质量(g) | 实际回收 | ||||
| 1 | 0.6 | - | - | - | 10 | 480 |
| 2 | 0.6 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.6 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.6 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.6 | Cr2O3 | 0.20 | 异常 | 67.2(有刺激性气味) | 188.3 |
| A、催化剂的催化能力Fe2O3>MnO2>CuO |
| B、实验2、3、4中KClO3分解百分率相同 |
| C、实验1设计对本实验无意义 |
| D、Cr2O3在反应中起到还原剂作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属与盐溶液反应都是置换反应 |
| B、阴离子都只有还原性 |
| C、与强酸、强碱都反应的物质只有两性氧化物或两性氢氧化物 |
| D、在潮湿的环境下,黄铜(锌铜合金)比纯铜更耐腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com