
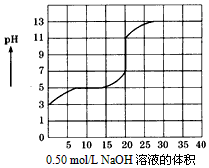
 在100mL某一元弱酸的溶液中,以0.50mol/L氢氧化钠溶液滴定后得滴定曲线如图所示,下列叙述正确的是( )
在100mL某一元弱酸的溶液中,以0.50mol/L氢氧化钠溶液滴定后得滴定曲线如图所示,下列叙述正确的是( )| A. | 该弱酸在滴定前的浓度是0.15mol/L | |
| B. | 该弱酸的电离常数(Ka)是10-5 | |
| C. | 在滴定过程,为求滴定终点,最合适的指示剂是甲基橙 | |
| D. | 在滴定过程中,滴定前俯视,滴定后仰视,会使测定结果偏小 |
分析 A.加入20mLNaOH溶液时出现滴定飞跃,说明此时酸碱恰好反应,据此可计算出该酸的浓度;
B.设该酸的化学式为HA,滴定前HA的pH=3,HA浓度为0.10mo/L,c(H+)≈c(A-)=1×10-3mol/L,c(HA)≈0.10mol/L,据此可计算出该酸的平衡常数;
C.甲基橙的变色范围为3.1-4.4,而从图象可以看出用NaOH滴定盐酸溶液达到终点pH范围是在7~11,应该用酚酞;
D.滴定前俯视,滴定后仰视,导致计算出的标准液体积偏大,测定结果偏高.
解答 解:A.根据图象可知,加入20mLNaOH溶液时出现滴定飞跃,说明此时酸碱恰好反应,则该酸滴定前的浓度=$\frac{0.50mol/L×0.02L}{0.1L}$=0.10mol/L,故A错误;
B.设该酸的化学式为HA,滴定前HA的pH=3,HA浓度为0.10mo/L,则c(H+)≈c(A-)=1×10-3mol/L,c(HA)≈0.10mol/L,所以该稳定性HA该酸的电离平衡常数为:K=$\frac{1×1{0}^{-3}×1×1{0}^{-3}}{0.10}$=10-5,故B正确;
C.从图象可以看出,用NaOH滴定盐酸溶液达到终点pH范围是在7~11,变色范围最合适的指示剂是酚酞,故C错误;
D.在滴定过程中,滴定前俯视,读出的数据偏小,滴定后仰视,读出的标准液体积偏大,最终导致消耗标准液体积偏大,会使测定结果偏大,故D错误;
故选B.
点评 本题考查中和滴定,题目难度中等,正确判断滴定终点为解答关键,注意掌握中和滴定原理及操作方法,试题培养了学生的分析能力及化学实验、化学计算能力.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,将相同体积的pH=3硫酸和pH=11一元碱BOH溶液混合,所得溶液可能为中性也可能为碱性 | |
| B. | pH=2的盐酸和0.01mol/L的醋酸溶液中,氢离子浓度不同,但溶质的物质的量相等 | |
| C. | 常温下水电离出的c(H+)水•c(OH-)水=10-20的溶液中一定可以存在Na+、Cl-、S2-、SO32-四种离子 | |
| D. | 由CH3COONa和CH3COOH混合而成的中性溶液中,粒子浓度关系为c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸性氧化物 | |
| 碱性氧化物 | |
| 两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上层倒出 | |
| B. | 用洁净干燥的玻璃棒蘸取盐酸滴在pH试纸上,读数为3.2 | |
| C. | 蒸馏操作时,温度计应该插入到液体内部以测量温度 | |
| D. | 蒸发操作时,不能加热至水分完全蒸干 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和聚乙烯都能使溴水、酸性高锰酸钾溶液褪色 | |
| B. | 乙酸、乙酸乙酯都能发生取代反应,乙酸乙酯中的少量乙酸可用饱和NaOH溶液除去 | |
| C. | 乙烷、乙烯、乙醇和乙酸互为同系物,葡萄糖与果糖互为同分异构体 | |
| D. | 淀粉、植物油、蛋白质都能水解,但水解产物不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com