
| A、c(OH-)=c(Na+)>c(HCOO-)>c(H+) |
| B、c(Na+)=c(HCOO-) |
| C、c(Na+)>c(HCOO-)>c(H+)>c(OH-) |
| D、c(H+)>c(HCOO-)>c(Na+)>c(OH-) |


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
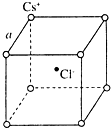 如图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为a cm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )
如图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为a cm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为( )A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、4:19 | B、3:5 |
| C、1:3 | D、2:17 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素由化合态变成游离态时,它可能被氧化,也可能被还原 |
| B、11.2L Cl2通入足量的NaOH溶液中,转移的电子数为0.5NA |
| C、难失电子的原子,得电子的能力一定强 |
| D、在氧化还原反应中,有一种元素被氧化,肯定有另一种元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、②③④⑤ |
| C、①②④⑤ | D、①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol 金属钠含有的电子数 |
| B、标准状况下,22.4 L 苯所含的分子数 |
| C、0.012 kg 12C所含的原子数 |
| D、1 L 1 mol?L-1硫酸溶液所含的H+数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2:3 | B、3:4 |
| C、11:3 | D、10:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将乙烯和乙炔气体分别通入溴的四氯化碳溶液中前者退色,后者不退色 |
| B、甲烷和氯气在室温下的黑暗环境中可以稳定存在 |
| C、苯能使溴水退色是因为二者反应生成了溴苯 |
| D、要除去乙烷中的乙烯制得纯净的乙烷,可将混合气通入酸性高锰酸钾溶液中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com