
科学家一直致力于“人工固氮”的方法研究。
(1)合成氨的原理为:N2(g)+3H2(g)  2NH3(g)
2NH3(g)  H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。
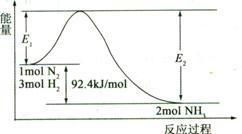
①在反应体系中加入催化剂,反应速率增大,E2的变化是 (填“增大”、“减小”或“不变”)。
②将0.3 mol N2和0.5 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,测得容器内气体压强变为原来的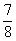 ,此时H2的转化率为 (计算出结果);欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
,此时H2的转化率为 (计算出结果);欲提高该容器中H2的转化率,下列措施可行的是 (填选项字母)。
A.向容器中按原比例再充入原料气 B.向容器中再充入一定量H2
C.改变反应的催化剂 D.液化生成物分离出氨
(2)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(1)  4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H=+1530 kJ/mol
H=+1530 kJ/mol
又知:H2O(1)=H2O(g)  H=+44.0 kJ/mol
H=+44.0 kJ/mol
则2N2(g)+6H2O(g)  4NH3(g)+3O2(g)
4NH3(g)+3O2(g)  H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
H = kJ/mol,该反应的化学平衡常数表达式为K= ,控制其他条件不变,增大压强,K值 (填“增大”、“减小”或“不变”)。
科目:高中化学 来源: 题型:
燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是 ( )
A.甲醇 B.天然气
C.液化石油气 D.氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
往容积为10 L的密闭容器内通入40 mol N2和120 mo l H2,在一定条件下进行反应,经2s后达到平衡状态,平衡时c(N2)为2 mol/L。
l H2,在一定条件下进行反应,经2s后达到平衡状态,平衡时c(N2)为2 mol/L。
(1)用H2的浓度变化表示2 s内的平均速率v(H2)=__________。
(2)氮气的转化率是__________ 。
(3)平衡时混合气体中氨的体积分数是__________ 。
(4)反应开始与平衡时的压强之比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是
A.同一主族元素的气态氢化物,其相对分子质量越大,对应的熔、沸点一定越高
B.升高温度可加快反应速率,其主要原因是反应物分子能量增加,单位体积活化分子的数目增多,活化分子的百分数不变,使得有效碰撞次数增多
C.若R2-离子和M+离子的电子层结构相同,则原子序数:R>M
D.若弱酸HA的酸性强于弱酸HB,则同浓度钠盐溶液的pH:NaA<NaB
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L苯中含有的C-H键的数目为0.6NA
B.标准状况下,由H2O2分解制得4.48LO2转移的电子数目为0.8NA
C.14 g 由乙烯与环丙烷(C3H6)组成的混合气体含有的碳原子数目为NA
D.常温下,1 L pH=2的H2SO4溶液中含有的H+数目为0.02NA
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X+、Y2+、Z-、W2-四种离子均具有相同的电子层结构,下列关于X、Y、Z、W四种元素的描述,不正确的是
A.原子半径:X>Y>W>Z B.原子序数:Y>X>Z>W
C.原子最外层电子数:Z>W>Y>X D. 离子半径:X+>Y2+>W2->Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
若不断地升高温度,实现“雪花―→水―→水蒸气―→氧气和氢气”的变化。在变化的各阶段被破坏的微粒间的相互作用依次是 ( )
A.氢键;分子间作用力;非极性键 B.氢键;分子间作用力;极性键
C.氢键;极性键;分子间作用力 D.分子间作用力;氢键;非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是( )
A.含有共价键的化合物一定是共价化合物 B.含有离子键的化合物一定是离子化合物
C.含非极性键的纯净物一定是单质 D.原子最外层2个电子的元素一定在ⅡA族
查看答案和解析>>
科目:高中化学 来源: 题型:
既可以用来鉴别甲烷和乙烯,又可以用来除去甲烷中混有的少量乙烯的是
A.气体通过盛有酸性高锰酸钾溶液的洗气瓶 B.气体通过盛有足量溴水的洗气瓶
C.气体通过盛有足量蒸馏水的洗气瓶 D.气体与适量HCl混合
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com