
【题目】下列说法正确的是( )
A.对于有气体参与的反应,增大压强,活化分子总数增多,化学反应速率增大
B.对放热反应而言,升高温度,活化分子百分数减少,化学反应速率减小
C.活化分子间发生的碰撞为有效碰撞
D.使用催化剂,活化分子百分数增多,化学反应速率增大
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数的量)( )
A. 在常温常压下, ![]() 氧气和臭氧组成的混合气体中所含氧原子数目为NA
氧气和臭氧组成的混合气体中所含氧原子数目为NA
B. 1mol![]() (碳正离子)中含电子数目为10NA
(碳正离子)中含电子数目为10NA
C. 标准状况下,22.4LSO3中含有的氧原子数为3NA
D. 200mL 0.5mol/L硝酸铵溶液中含有![]() 0.1NA
0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢叠氮酸(HN3)及其盐(如NaN3、NH4N3、CuN3等)都具有爆炸性,最近南京理工大学胡丙成教授团队成功合成出PHAC,其化学式为(N3)6(H3O)3(NH4)4Cl。回答下列问题:
(1)PHAC中“N3”的化合价为______。N2F2的电子式为_______。
(2)汽车安全气囊中的NaN3可发生下列反应:
NaN3(s)=Na(s)+3/2N2(g) △H1;
2NaN3(s)+CuO(s)=Na2O(s)+3N2(g)+Cu(s) △H1;
则反应CuO(s)+2Na(s)=Na2O(s)+Cu(s) △H=_______(用△H1和△H2表示)
(3)25℃时,将lmolNH4N3投入一2L的恒容密闭容器中,0.5min后反应达到平衡,测得生成的两种单质的物质的量之和为1.6mol, 则NH4N3的平衡转化率为_______,25℃时该反应的平衡常数K=________。
(4)氢叠氮酸(HN3)易溶于水,且酸性与醋酸相近。
①HN3在水溶液中的电离方程式为_______________.
② 0.1mol/L的HN3溶液与0.1mol/L的NaN3等体积混合,混合溶液中各离子浓度由大到小的顺序为__________________。
③ 已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下反应:
Cu2S(s)+2N3-(aq)![]() 2CuN3(s)+S2-(aq)的平衡常数K=_________.
2CuN3(s)+S2-(aq)的平衡常数K=_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】痕检是公安机关提取犯罪嫌疑人指纹的一种重要的方法,AgNO3显现法就是其中一种:人的手上有汗渍,用手动过白纸后,手指纹线就留在纸上。如果将溶液①小心涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由棕色变成黑色的指纹线。用下列化学式表示这三种物质都正确的是 ( )
A.①AgNO3;②NaBr;③AgBr B.①AgNO3;②NaCl;③AgCl
C.①AgCl; ②AgNO3;③NaCl D.①AgNO3;②NaCl;③Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂有一个氯气钢瓶发生损坏,造成氯气泄漏。下列处理钢瓶的方法较合理的是
A.把钢瓶丢到深坑中,用石灰掩埋B.把钢瓶推到小河中
C.把钢瓶抬到下风口的地方并遗弃D.把钢瓶抬到上风口的地方并遗弃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能源与能量的说法正确的是( )
A.煤和石油是经过亿万年形成的,亿万年后煤和石油还会生成,故二者属可再生能源
B.蒸汽属于一次能源
C.凡经过加热而发生的反应都是吸热反应,常温下进行的反应都是放热反应
D.反应物和生成物的总能量决定反应是放热还是吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“千年大计、国家大事”,雄安新区无疑是今年最受瞩目的地区。不过,近日媒体报道河北廊坊、天津等地存在超大规模的工业污水渗坑,给雄安新区的水环境带来隐患,目前正采用多种方法对污水进行处理,改善水资源状况。
(1)在微生物作用的条件下,废水中的NH4+经过两步反应氧化成NO3-,两步反应的能量变化示意图如下:
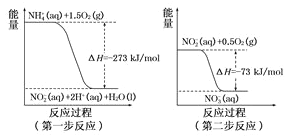
①第一步反应是______反应(选填“放热”或“吸热”),判新依据是_________。1mol NH4+ (aq)全部氧化成NO3- (aq)的热化学方程式为_____________。
②一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该过程中CH3OH反应生成CO2,则参加反应的还原剂和氧化剂的物质的量之比为______.
(2)二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认为安全、无毒的绿色消毒剂,可以投入废水中清除污染物。
①二氧化氯可以将废水中的氰化物(CN-)氧化成两种无污染气体.写出离子方程式________。
②废水中的重金属离子的危害性很大,二氧化氯能够在弱酸性溶液中把二价锰离子氧化成不溶于水的二氧化锰(MnO2),写出反应的离子方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常以烃的含氧衍生物X为主要原料生产可降解塑料PCL{![]() }及阻燃剂四溴双酚A.合成线路如下:
}及阻燃剂四溴双酚A.合成线路如下:
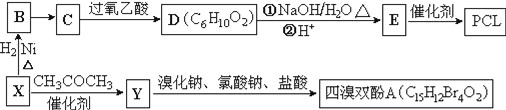
已知:①X的蒸汽密度是相同条件下H2的47倍,遇FeCl3溶液显紫色;C为![]() 。
。
②![]() 。
。
③RCOCH2R′![]() RCOOCH2R′。
RCOOCH2R′。
(1)B的名称是_________________。
(2)B→C还需要的反应试剂及条件是___________。C→D的反应类型是______________________。
(3)写出X→Y的化学方程式:_______________________________。
(4)0.5mol四溴双酚A在一定条件下与足量的NaOH溶液反应,最多消耗__molNaOH。
(5)符合以下条件的D的同分异构体有__种(不考虑空间异构)。
①含有两个甲基和两种官能团 ②能使溴的CCl4溶液褪色 ③能发生银镜反应
(6)已知由烯烃直接制备不饱和酯的新方法为:
![]()
利用乙烯为有机原料(无机物和反应条件自选)合成聚合物涂料![]() ,写出合成该涂料的反应流程图:________________________________。
,写出合成该涂料的反应流程图:________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com