
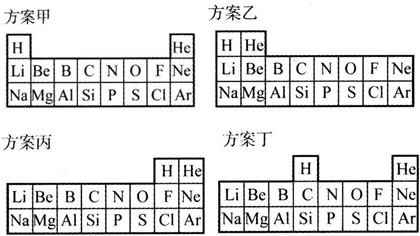
| “合理”的理由 | |
| 方案甲 | |
| 方案乙 | |
| 方案丙 | |
| 方案丁 |
分析 (1)甲是根据其最外层电子数及最外层电子数是否达到稳定结构判断;
乙是根据其原子最外层电子数排列;
丙是根据得失电子数判断;
丁是根据最外层电子数判断;
(2)方案丙中把H放在第ⅦA族是因为氢也可得到一个电子形成稳定结构,从而显-1价;
(3)方案丁中H和C、Si一样形成化合物时最高正化合价等于最低负化合价的绝对值;
(4)最外层电子数为1的短周期元素可以为非金属元素H,也可以是金属元素Li、Na等;最外层电子数为2的短周期元素可以为稀有气体元素He,也可以是金属元素Be、Mg等.
解答 解:(1)甲中H与Li、Na等第ⅠA族元素的原子最外层均有一个电子,He与Ne、Ar等稀有气体元素的原子最外层都已达稳定结构;
乙中He与Be、Mg等第ⅡA族元素的原子最外层电子数均为2;
丙中H与F、Cl等第ⅦA族元素的原子均可得一个电子形成稳定结构;
丁中H与C、Si等第ⅣA族的非金属元素原子都不易得到或失去电子形成稳定结构,
故答案为:
| “合理”的理由 | |
| 方案甲 | H与Li、Na等第ⅠA族元素的原子最外层均有一个电子,He与Ne、Ar等稀有气体元素的原子最外层都已达稳定结构 |
| 方案乙 | He与Be、Mg等第ⅡA族元素的原子最外层电子数均为2 |
| 方案丙 | H与F、Cl等第ⅦA族元素的原子均可得一个电子形成稳定结构 |
| 方案丁 | H与C、Si等第ⅣA族的非金属元素原子都不易得到或失去电子形成稳定结构 |
点评 本题考查元素周期表结构及元素排列,为高频考点,侧重考查学生分析总结归纳能力,根据原子核外电子排布特点来分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{288V}$mol/L | B. | $\frac{125a}{36V}$mol/L | C. | $\frac{125a}{18V}$mol/L | D. | $\frac{125a}{54V}$mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C60能溶于二硫化碳中形成无色透明的溶液,可以用相似相溶原理解释 | |
| B. | 向含有Fe2+的溶液中滴加无色的铁氰化钾溶液,可以观察到蓝色沉淀产生 | |
| C. | 甲烷是空间正四面体结构,四个氢的相对位置完全等效,其任意取代物都不会产生同分异构现象 | |
| D. | 电子云是处于一定空间运动状态的电子在原子核外空间的概率密度分布的形象化描述 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
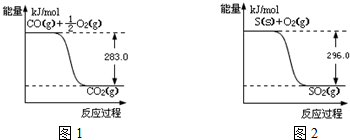
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
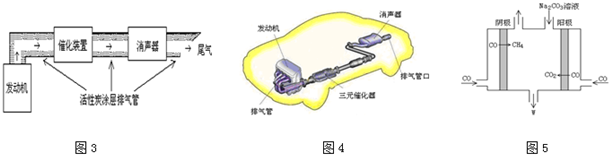
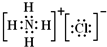 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
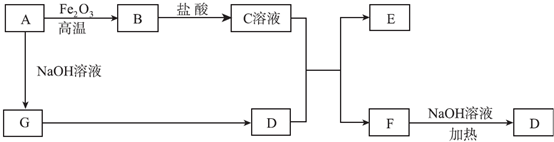
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 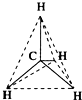 结构示意图 | B. |  电子式 | C. | 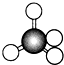 球棍模型 | D. | 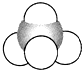 比例模型 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 [Cu(NH3)4]SO4•H2O是一种杀虫剂.
[Cu(NH3)4]SO4•H2O是一种杀虫剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL12mol/L浓盐酸与足量的MnO2加热充分反应生成氯气分子数为0.3 NA | |
| B. | 5.6 g铁粉与硝酸反应失去的电子数一定为0.3NA | |
| C. | 向FeI2溶液中通入适量Cl2,当有1 mol Fe2+被氧化时,共转移的电子的数目为NA | |
| D. | 5.4g铝粉与足量的氢氧化钠溶液充分反应生成氢气分子数为0.3 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com