
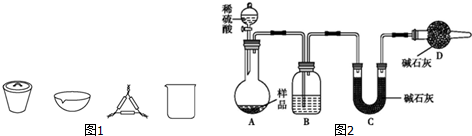
分析 [方案一]碳酸氢钠不稳定,受热易分解,根据加热前后固体质量变化,根据差量法求碳酸氢钠的质量,进而求得碳酸钠的质量分数;
(1)在灼烧固体样品时必须在坩埚中进行,根据使用坩埚加热使用到的仪器答题;
(2)加热恒重保证碳酸氢钠完全分解;
(3)若加热过程中有晶体迸溅出来,使得剩余的固体质量偏小,据此答题;
[方案二]碳酸钠和碳酸氢钠都和氢氧化钡反应生成碳酸钡沉淀,根据生成沉淀的质量来计算碳酸钠的质量分数.
(1)根据过滤操作考虑所需仪器;
(2)可取上层清液,继续加沉淀剂,看是否生成沉淀;
(3)判断沉淀是否洗涤干净的方法是检验沉淀上是否含有钡离子;
[方案三](1)由测定含量的实验可知,A中发生Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑,B中为浓硫酸吸收水,干燥二氧化碳,利用C装置吸收二氧化碳,D装置防止空气中的二氧化碳、水进入C装置干扰含量测定,盐酸易挥发,对实验产生干扰;
(2)结合反应定量关系和元素守恒计算得到物质的质量,来计算物质含量;
(3)二氧化碳气体不能全部进入C装置被吸收,需要添加一个吧二氧化碳气体赶入装置C的装置.
解答 解:[方案一](1)在灼烧固体样品时必须在坩埚中进行,要用泥三角支撑,
故答案为:坩埚、泥三角;
(2)实验原理是根据加热前后固体质量变化来计算碳酸氢钠,故应保证碳酸氢钠完全分解,加热恒重则碳酸氢钠完全分解,
故答案为:保证NaHCO3分解完全;
(3)若加热过程中有晶体迸溅出来,使得剩余的固体质量偏小,即计算得碳酸氢钠的质量偏大,所以计算得样品中Na2CO3的质量分数偏小,
故答案为:偏小;
[方案二](1)过滤时需用玻璃棒引流,
故答案为:玻璃棒;
(2)可取上层清液,继续加沉淀剂,看是否生成沉淀,具体操作为:取上层清液少许于试管中,加入氢氧化钡溶液,若无沉淀生成,则沉淀完全,
故答案为:取少量上层清液于一支试管中,滴加Ba(OH)2溶液,观察是否有白色沉淀生成;
(3)判断沉淀是否洗涤干净的方法是检验沉淀上是否含有钡离子,操作为取少量最后一次洗涤沉淀的滤液于试管中,滴加一滴Na2SO4溶液,观察是否有白色沉淀生成,
故答案为:取少量最后一次洗涤沉淀的滤液于试管中,滴加一滴Na2SO4溶液,观察是否有白色沉淀生成;
[方案三](1)空气中的水蒸气和二氧化碳会被碱石灰吸收,故D的作用是吸收空气中的水蒸气和二氧化碳,以确保C装置中质量增加量的准确性;分液漏斗中如果用盐酸代替硫酸,盐酸易挥发,这样制得二氧化碳气体中含氯化氢,浓硫酸不能吸收氯化氢,则氯化氢被碱石灰吸收,导致测到二氧化碳质量偏高,等质量碳酸钠和碳酸氢钠,碳酸氢钠产生二氧化碳多,则会导致碳酸氢钠偏多,碳酸钠偏小,
故答案为:浓H2SO4;防止空气中的水蒸气、二氧化碳进入C装置;不能;
(2)设NaHCO3和Na2CO3的物质的量分别为x、y,则
Na2CO3+H2SO4=H2O+CO2↑+Na2SO4、
x x
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
106x+84y=17.90
44x+44y=8.80
,解得x=0.05mol
y=0.15mol
则样品中Na2CO3的质量分数为$\frac{0.05mol×106g/mol}{17.90g}$×100%=29.6%,
故答案为:29.6%;
(3)实验装置还存在一个明显缺陷为装置中的二氧化碳不能被C全部吸收,则需设计一个装置将A、B中的CO2全部吹入C中吸收,
故答案为:缺少一个驱赶残留二氧化碳气体的装置.
点评 本题考查碳酸钠含量的测定实验,为高频考点,把握实验装置的作用及实验目的为解答的关键,侧重分析、计算及实验能力的综合考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 熔点260.7K | B. | 具有很高的比热 | C. | 可作冷却剂 | D. | 能跟水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池放电时Na+从b极区移向a极区 | |
| B. | 电极b采用MnO2,MnO2既作电极材料又有催化作用 | |
| C. | 每消耗1 mol H2O2,转移的电子为1 mol | |
| D. | 该电池的正极反应为BH4-+8OH--8e-═BO2-+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(NH4+)>c(Cl-),c(OH-)>c(H+) | B. | c(Cl-)>c(NH4+),c(OH-)>c(H+) | ||
| C. | c(Cl-)>c(NH4+),c(H+)>c(OH-) | D. | c(NH4+)=c(Cl-),c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;反应类型:消去反应;
;反应类型:消去反应; ;反应类型:酯化反应或取代反应.
;反应类型:酯化反应或取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子内共价键越强,分子越稳定,其熔沸点也越高 | |
| B. | C、H、O、N四种元素组成的化合物一定是离子化合物 | |
| C. | HF分子间存在着氢键,所以HF比HCl稳定 | |
| D. | 由原子构成的晶体可能是原子晶体,也可能是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①②③④ | C. | ②③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
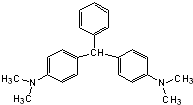 无色孔雀石绿(结构简式如图所示)曾被用作水产养殖业的杀虫剂(鱼药).因为具有潜在致癌性,已被禁止用作鱼药,下列关于无色孔雀石绿的叙述中,正确的是( )
无色孔雀石绿(结构简式如图所示)曾被用作水产养殖业的杀虫剂(鱼药).因为具有潜在致癌性,已被禁止用作鱼药,下列关于无色孔雀石绿的叙述中,正确的是( )| A. | 分子中所有的碳原子可能在同一平面上 | |
| B. | 无色孔雀石绿与氢气完全加成后的产物的核磁共振氢谱中有7个峰 | |
| C. | 无色孔雀石绿可与溴水中的溴发生加成反应 | |
| D. | 在一定条件下,1mol无色孔雀石绿可以和9mol氢气发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com