
| 键 | C-C | C-H | O=O | H-O | C-O | C=O |
| 键能/(kJ•mol-1) | 348 | 413 | 498 | 463 | 351 | 799 |
| 实验编号 | 实验步骤 | 实验现象 |
| 1 | 向4mL无水乙醇中加入1mL溴水,充分振荡,静置4小时 | 溶液橙黄色褪去,溶液接近无色 |
| 2 | 向4mL无水乙醇中加入1mL溴水,加热至沸腾 | 开始现象不明显,沸腾后溶液迅速褪色 |
| 向淀粉KI溶液中滴加冷却后的上述混合液 | 溶液颜色不变 | |
| 3 | 向4mL水中加入1mL溴水,加热至沸腾 | 橙黄色略变浅 |
| 向淀粉KI溶液中滴加冷却后的溴水混合液 | 溶液变蓝 |
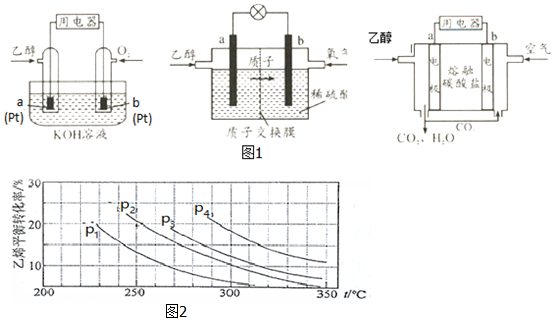
分析 Ⅰ反应热=反应物总键能-生成物总键能,注明物质的聚集状态与焓变书写热化学方程式;
Ⅱ(1)正极上O2得电子发生还原反应;
(2)负极上燃料失电子发生氧化反应,空气中的CO2会与KOH溶液反应,降低溶液的碱性,同时反应中也会消耗KOH;
(3)电池的两极分别充入乙醇和氧气,形成原电池反应时,乙醇被氧化,应为负极,b为正极,通过质子交换膜的离子是H+;
(4)原电池中阴离子向负极移动,电极b上发生还原反应;
Ⅲ(1)在相同温度下由于乙烯转化率为p1<p2<p3<p4,正反应为气体体积减小的反应,增大压强平衡向正反应分析移动,乙烯的转化率增大;
(2)若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以改变物质的浓度;
Ⅳ(1)①检验反应后溶液中是否还含有溴单质;
②实验3的作用是对比实验,验证在加热条件下水是否能够与溴单质反应;
③根据实验现象得出的结论是加热条件下或长期放置,乙醇能够与溴水反应;
(2)根据发生氧化反应,则Br2全部转化为HBr,发生取代反应,则Br2一半转化为HBr.
解答 解:Ⅰ反应热=反应物总键能-生成物总键能,则C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)△H=348kJ/mol+413×5kJ/mol+351kJ/mol+463kJ/mol+498×3kJ/mol-799×2×2kJ/mol-463×2×3kJ/mol=-1253kJ/mol,故答案为:C2H5OH(g)+3O2(g)2CO2(g)+3H2O(g)△H=-1253kJ/mol
Ⅱ(1)正极发生还原反应,三种乙醇燃料电池中正极反应物均为O2,故答案为:O2;
(2)负极上乙醇失电子和水反应生成二氧化碳和氢离子,电极反应式为CH3CH2OH-12e-+3H2O=2CO2+12H+,空气中的CO2会与KOH溶液反应,降低溶液的碱性,同时反应中也会消耗KOH,故答案为:CH3CH2OH-12e-+3H2O=2CO2+12H+;空气中的CO2会与KOH溶液反应,降低溶液的碱性,同时反应中也会消耗KOH;
(3)电池的两极分别充入乙醇和氧气,形成原电池反应时,乙醇被氧化,应为负极;b为正极,正极发生O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O;H+;
(4)原电池中阴离子向负极移动,所以CO32-向负极(a)移动,电极b上发生还原反应,故答案为:a;O2+2CO2+4e- 2CO32-;
Ⅲ(1)由图可知,在相同温度下乙烯转化率为p1<p2<p3<p4,由C2H4(g)+H2O(g)═C2H5OH(g)△H=-45.5kJ•mol-1,可知正反应为气体体积减小的反应,所以增大压强,平衡正向移动,乙烯的转化率提高,因此压强关系是p1<p2<p3<p4,故答案为:p1<p2<p3<p4;反应分子数减少,相同温度下,压强升高乙烯转化率提高;
(2)若要进一步提高乙烯转化率,除了可以适当改变反应温度和压强外,还可以改变物质的浓度,如从平衡体系中将产物乙醇分离出来,或增大水蒸气的浓度,改变二者物质的量的比等,故答案为:将产物乙醇液化移去;增加nH2O:nC2H4比;
Ⅳ(1)①检验反应后溶液中是否还含有溴单质,故答案为:检验反应后溶液中是否还含有溴单质;
②实验3的作用是对比实验,验证在加热条件下水是否能够与溴单质反应,故答案为:对比实验,验证在加热条件下水是否能够与溴单质反应;
③根据实验现象得出的结论是加热条件下或长期放置,乙醇能够与溴水反应,故答案为:加热条件下或长期放置,乙醇能够与溴水反应;
(2)根据发生氧化反应,则Br2全部转化为HBr,发生取代反应,则Br2一半转化为HBr,取含a mol Br2的溴水和足量的乙醇,混合加热,完全反应后利用AgNO3标准液滴定测定溶液中Br-物质的量.若n(Br-)=a mol则发生取代反应;若n(Br-)=2a mol则发生氧化反应;若a mol<n(Br-)<2a mol则既发生了取代反应也发生了氧化反应.故答案为:取含a mol Br2的溴水和足量的乙醇,混合加热,完全反应后利用AgNO3标准液滴定测定溶液中Br-物质的量.若n(Br-)=a mol则发生取代反应;若n(Br-)=2a mol则发生氧化反应;若a mol<n(Br-)<2a mol则既发生了取代反应也发生了氧化反应.
点评 本题考查了化学实验方案的评价、官能团的性质和检验应用、化学方程式的书写、压强对平衡移动的影响、物质制取方案的比较、反应热的计算等知识,综合性非常强,该题是高考中的常见题型,属于中等难度,侧重于学生分析问题、解决问题、知识迁移能力的培养.


科目:高中化学 来源: 题型:选择题
| A. | 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅 | |
| B. | 硫酸铁易溶于水,可作净水剂 | |
| C. | 我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料 | |
| D. | 减少烟花爆竹的燃放,有利于降低空气中的PM2.5含量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
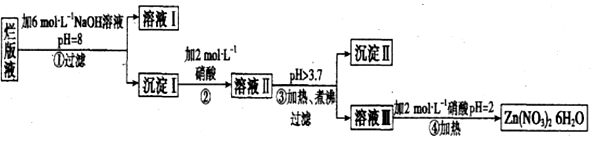
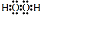 .溶液 I中加入H2O2溶液发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.
.溶液 I中加入H2O2溶液发生反应的离子方程式是2Fe2++H2O2+2H+=2Fe3++2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
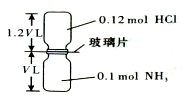 已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( )
已知反应:HCl+NH3=NH4Cl(固体)如图所示,抽去装置中的玻璃片,使两种气体充分反应(整个过程中认为装置气密性良好),等温度恢复到原来温度.下列说法正确的是( )| A. | 反应后瓶内压强是反应前的$\frac{1}{10}$ | |
| B. | 装置中氢元素的总质量为0.42 g | |
| C. | 生成物的分子数目为0.1 NA | |
| D. | 反应结束后,两个集气瓶很容易分开 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 平衡时,各容器的压强:②=①=③ | B. | 平衡时,I2的浓度:②>①=③ | ||
| C. | 平衡时,I2的体积分数:②=①=③ | D. | 从反应开始到达平衡的时间:①>②=③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与等体积pH=11的NaOH溶液混合后所得溶液显酸性 | |
| B. | c(H+)=c(CH3COO-)+c(OH-) | |
| C. | 该溶液中由水电离出的c(H+)是1.0×10-11 mol/L | |
| D. | 加入少量CH3COONa固体后,c(CH3COO-)降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL 1mol/LAlCl3溶液 | B. | 200 mL 1mol/LMgCl2溶液 | ||
| C. | 100mL 0.5mol/LCaCl2溶液 | D. | 100 mL 2 mol/L KCl溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com