
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.金属钠与冷水反应:Na+2H2O====Na++2OH-+H2↑ |
| B.碳酸钙投入醋酸溶液中CaCO3+2CH3COOH====Ca2++2CH3COO-+H2O+CO2↑ |
| C.向Ca(ClO)2溶液中通过量CO2气体:Ca2++2ClO-+CO2+H2O====CaCO3↓+2HClO |
D.向硫酸铜溶液中滴入Ba(OH)2溶液:Ba2++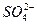 ====BaSO4↓ ====BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
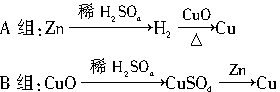
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.SO2+Br2+2H2O H2SO4+2HBr与2HBr+H2SO4(浓) H2SO4+2HBr与2HBr+H2SO4(浓)  Br2+SO2↑+2H2O互为可逆反应 Br2+SO2↑+2H2O互为可逆反应 |
| B.既能向正反应方向进行,又能向逆反应方向进行的反应叫可逆反应 |
| C.在同一条件下,同时向正、逆两个方向进行的反应叫可逆反应 |
| D.在一定条件下,SO2被氧化成SO3的反应是可逆反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 、
、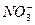 、
、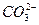 、
、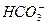 ,现进行如下实验:
,现进行如下实验:查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com