
 实验室用如图所示的装置制取乙酸乙酯。
实验室用如图所示的装置制取乙酸乙酯。
(1)在试管中配制一定比例的乙醇、乙酸和浓硫酸的混合溶液,其方法是______________。
(2)装置中通蒸气的导管应置于饱和碳酸钠溶液的液面上而不能插入溶液中,目的是防止溶液倒吸,造成倒吸的原因是_________________。
(3)浓硫酸的作用是①________;②________。
(4)饱和碳酸钠溶液的作用是______________________。
(5)反应时生成的乙酸乙酯密度比水________,有________气味。
科目:高中化学 来源: 题型:
下列叙述中,正确的是( )
A.石油、煤、天然气、氢气都属于化石燃料
B.常温下,反应C(s)+CO2(g)=2CO(g)不能自发进行,则该反应的ΔH<0
C.人们通常用标准燃烧热或热值来衡量燃料燃烧放出热量的大小,某物质的热值越高则其标准燃烧热越大
D.两个体积相同的容器中充入等量的NO2发生反应:2NO2(g)
 N2O4(g) ΔH<0,绝热容器中气体的颜色比恒温容器中颜色深
N2O4(g) ΔH<0,绝热容器中气体的颜色比恒温容器中颜色深
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,甲(恒容)、乙(恒压)、丙(恒容)3个密闭容器中发生可逆反应:
2SO2(g)+O2(g) 2SO3(g)ΔH = -197 kJ/mol。实验测得起始、平衡时的有关数
2SO3(g)ΔH = -197 kJ/mol。实验测得起始、平衡时的有关数
据如下表。下列正确的是
| 容器 | 起始各物质的物质的量/mol | 达到平衡时体系能量的变化 | ||
| SO2 | O2 | Ar | ||
| 甲 | 2 | 1 | 0 | 放出热量:Q1 |
| 乙 | 2 | 1 | 0 | 放出热量:Q2 |
| 丙 | 2 | 1 | 0.5 | 放出热量:Q3 |
A.Q1 =Q3<Q2
B.达到平衡时,乙容器中SO2的体积分数最大
C.平衡时,甲、乙、丙3个容器中甲的平衡常数最小
D.若在上述条件下,反应生成1molSO3(s),则反应放热为98.5kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于有机物的说法正确的是
( )。
A.乙烯能使酸性KMnO4溶液和溴水褪色,二者反应原理不相同
B.交警用酸性重铬酸钾溶液检查司机是否饮酒过量时乙醇发生取代反应
C.乙酸的分子式为CH3COOH,属于弱电解质
D.苯分子中没有碳碳双键,因此苯不能发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物的结构简式如图: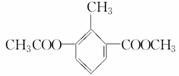 ,关于该物质的叙述错误的是
,关于该物质的叙述错误的是
( )。
A.一个分子中含有12个H原子
B.苯环上的一氯代物有2种
C.含有一种含氧官能团
D.该物质与乙酸乙酯为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,把1 mL 0.1 mol·L-1的H2SO4加水稀释制成2 L溶液,在此溶液中由水电离产生的H+浓度接近于( )
A.1.0×10-4 mol·L-1 B.1.0×10-8 mol·L-1
C.1.0×10-11 mol·L-1 D.1.0×10-10 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
已知同温度下的溶解度:Zn(OH)2>ZnS,MgCO3>Mg(OH)2,溶解或电离出S2-的能力为FeS>H2S>CuS,下列离子方程式错误的是( )
A.Mg2++2HCO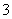 +2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O
+2Ca2++4OH-===Mg(OH)2↓+2CaCO3↓+2H2O
B.Cu2++H2S===CuS↓+2H+
C.Zn2++S2-+2H2O===Zn(OH)2↓+H2S↑
D.FeS+2H+===Fe2++H2S↑
查看答案和解析>>
科目:高中化学 来源: 题型:
化学反应经常伴随着颜色变化。下列有关反应的颜色变化正确的是( )
A.苯酚遇三氯化铁溶液变血红色
B.淀粉溶液遇碘酸钾变蓝色
C.植物油遇溴水变黄色
D.氧化铜遇热的乙醇变红色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com