
将镁和铝各0.3mol 分别放入足量的盐酸中,所生成的氢气在标准状况下的体积比是( )
|
| A. | 8:9 | B. | 1:1 | C. | 3:2 | D. | 2:3 |
考点:
镁的化学性质;化学方程式的有关计算;铝的化学性质.
专题:
计算题.
分析:
因酸足量,则金属都完全反应,然后利用化学反应方程式来计算氢气的物质的量,标准状况下气体的体积比等于其物质的量之比.
解答:
解:第一种解法:
镁和铝的物质的量都为0.3mol,设Mg与足量酸反应生成氢气的物质的量为x,Al与足量酸反应生成的氢气的物质的量为y,
则Mg+2HCl═MgCl2+H2↑
1 1
0.3mol x
 ,x=0.3mol,
,x=0.3mol,
2Al+6HCl═2AlCl3+3H2↑
2 3
0.3mol y
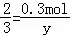 ,y=0.45mol,
,y=0.45mol,
标准状况下气体的体积比等于其物质的量之比,则生成的氢气在标准状况下的体积比为0.3mol:0.45mol=2:3,
第二种解法:
0.3mol镁、铝与足量酸反应时失电子的物质的量分别是0.6mol、0.9mol,根据转移电子守恒知,生成氢气的物质的量之比为0.6mol:0.9mol=2:3,标准状况下气体的体积比等于其物质的量之比,则生成氢气的体积之比为2:3,
故选D.
点评:
本题考查了物质的量的计算,根据镁、铝和氢气之间的关系式或根据转移电子守恒来分析解答即可,难度不大.


科目:高中化学 来源: 题型:
下列表示溶液中发生反应的化学方程式错误的是

| A.MnO 2 +4HCl(浓) MnCl 2 +Cl 2 ↑+2H 2 O |
| B.K 2 Cr 2 O 7 +6FeSO 4 +7H 2 SO 4 =Cr 2 (SO 4 ) 3 +3Fe 2 (SO 4 ) 3 +K 2 SO 4 +7H 2 O |
| C.2Al+2NaOH+2H 2 O=2NaAlO 2 +3H 2 ↑ |
| D.2KMnO 4 +HCOOK+KOH=2K 2 MnO 4 +CO 2 ↑+H 2 O |
查看答案和解析>>
科目:高中化学 来源: 题型:
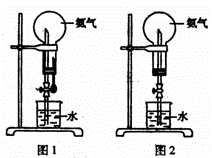
大气压强对许多物理实验和化学实验有着重要影响,制取氨气并完成喷泉实验.
(1)写出实验室制取氨气的化学方程式 .
(2)收集氨气应使用 法,要得到干燥的氨气可选用 做干燥剂.
(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是 ,该实验的原理是 .
(4)如果只提供如图2的装置,请说明引发喷泉的方法
.
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)0.5mol H2O的质量为 g,其中含有 个水分子,共有 个原子.
(2)质量为88g的CO2气体,其物质的量为 mol,在标准状况下体积约为 L.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 常温下,将铁片置于过量的浓硝酸中:Fe+6H++3NO3﹣═Fe3++3NO2↑+3H2O |
|
| B. | 加热条件下,铜与浓硫酸反应:4H++SO42﹣+Cu |
|
| C. | 常温下,向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42﹣═BaSO4↓ |
|
| D. | 常温下,向稀硝酸中加入过量的铁片:3Fe+8H++2NO3﹣═3Fe2++2NO↑+4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
将1.12g铁粉加入25mL2mol•L﹣1的氯化铁溶液中,充分反应后,其结果是( )
A. 铁粉有剩余,溶液呈浅绿色,Cl﹣基本保持不变
B. 往溶液中滴入无色KSCN溶液,溶液变红色
C. Fe2+和Fe3+物质的量之比为5:1
D. 氧化产物和还原产物的物质的量之比为2:5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com