
| A. | 2.24g | B. | 3.36g | C. | 5.60g | D. | 10.08g |
分析 n(H2)=$\frac{0.896L}{22.4L/mol}$=0.04mol,稀释后测得溶液中c(H+)为0.400mol/L,说明盐酸有剩余,则Fe、Fe2O3、CuO完全反应,混合物与盐酸充分反应有有固体残留,说明Fe3+完全反应,残留固体为Cu,n(Cu)=$\frac{1.28g}{64g/mol}$=0.02mol,且滤液中无Cu2+,则溶液中溶质为FeCl2,最后溶液中根据电荷守恒得2n(Fe2+)+n(H+)=n(Cl-),所以n(Fe2+)=$\frac{1}{2}$[n(Cl-)-n(H+)]=$\frac{1}{2}$[4.4mol/L×0.1L-0.400mol/L×0.2L]=0.18mol,设混合物中Fe的物质的量为xmol,根据Fe原子守恒得n(Fe2O3)=$\frac{0.18mol-xmol}{2}$,发生的反应中Fe失电子,Fe2O3、CuO和部分盐酸得电子,根据转移电子守恒得2n(Fe)=2n(Fe2O3)+2n(CuO)+2n(H2),即n(Fe)=n(Fe2O3)+n(CuO)+n(H2),xmol=$\frac{0.18mol-xmol}{2}$+0.02mol+0.04mol,再根据m=nM计算铁的质量.
解答 解:n(H2)=$\frac{0.896L}{22.4L/mol}$=0.04mol,稀释后测得溶液中c(H+)为0.400mol/L,说明盐酸有剩余,则Fe、Fe2O3、CuO完全反应,混合物与盐酸充分反应有有固体残留,说明Fe3+完全反应,残留固体为Cu,n(Cu)=$\frac{1.28g}{64g/mol}$=0.02mol,且滤液中无Cu2+,则溶液中溶质为FeCl2,最后溶液中根据电荷守恒得2n(Fe2+)+n(H+)=n(Cl-),所以n(Fe2+)=$\frac{1}{2}$[n(Cl-)-n(H+)]=$\frac{1}{2}$[4.4mol/L×0.1L-0.400mol/L×0.2L]=0.18mol,设混合物中Fe的物质的量为xmol,根据Fe原子守恒得n(Fe2O3)=$\frac{0.18mol-xmol}{2}$,发生的反应中Fe失电子,Fe2O3、CuO和部分盐酸得电子,根据转移电子守恒得2n(Fe)=2n(Fe2O3)+2n(CuO)+2n(H2),即n(Fe)=n(Fe2O3)+n(CuO)+n(H2),xmol=$\frac{0.18mol-xmol}{2}$+0.02mol+0.04mol,x=0.10
则m(Fe)=nM=0.10mol×56g/mol=5.60g,故选C.
点评 本题考查混合物的计算,为高频考点,正确获取题给信息、明确各物质之间发生的反应是解本题关键,注意:滤液中的Fe元素来自于铁和氧化铁、Fe不仅和稀盐酸反应还与铁离子及铜离子反应,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸的结构简式:C2H4O2 | B. | 氯化氢的电子式: | ||
| C. | 镁的原子结构示意图: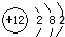 | D. | 水的电离方程式:H2O═H++OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
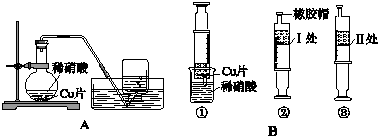
| A. | 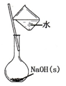 配置0.10mol/LnaOH溶液 | |
| B. | 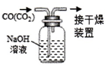 除去CO中的CO2 | |
| C. | 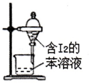 苯萃取碘水中的I2,分出水层后的操作 | |
| D. | 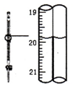 记录滴定终点读数为19.80mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的NaHSO4与Ba(OH)2溶液的反应:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| B. | 漂白粉溶液在空气中失效:ClO-+CO2+H2O═HClO+HCO3- | |
| C. | 酸性条件下KIO3和KI溶液反应生成I2:IO3-+5I-+3H2O═3I2+6 OH- | |
| D. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:Al3+、NH4+、Cl-、HS- | |
| B. | Na2CO3溶液中:K+、NH4+、SO42-、Cl- | |
| C. | 漂白粉的水溶液中:Fe2+、SO42-、Mg2+、Na+ | |
| D. | 水电离出的c(H+)=1×10-13mol•L-1的水溶液中:Ca2+、HCO3-、I-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 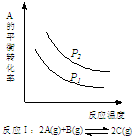 反应:△H>0,P2>P1 | B. | 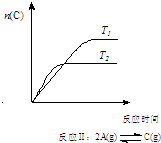 反应:△H<0,T1<T2 | ||
| C. | 反应:△H>0,T2>T1;或△H<0,T2<T1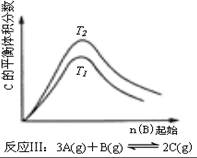 | D. | 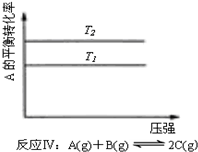 反应:△H<0,T2>T1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
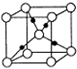 已知A、B、C、D、E、F、G、H均为前四周期元素且原子序数依次增大,A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;元素C的基态原子2p轨道有3个未成对电子,元素D的原子最外层电子数是其内层电子数的3倍,元素F的一种常见单质为淡黄色粉末,G的内层轨道全部排满电子,且最外层电子数为1.E是地壳中含量最高的金属元素;H与E同主族.
已知A、B、C、D、E、F、G、H均为前四周期元素且原子序数依次增大,A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;元素C的基态原子2p轨道有3个未成对电子,元素D的原子最外层电子数是其内层电子数的3倍,元素F的一种常见单质为淡黄色粉末,G的内层轨道全部排满电子,且最外层电子数为1.E是地壳中含量最高的金属元素;H与E同主族.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com