
(8分)
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4 (1) △H1= -19.5kJ·mol-1
②N2H4 (1) + O2(g)= N2(g) + 2 H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2O4 反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为 。
:(1)5;(2)2NH3+NaClO=N2H4+NaCl+H2O;(3)2N2H4(l)+ N2O4(l)=3 N2(g)+ 4H2O(g) △H=-1048.9kJ/mol;(4)N2H4+ 4OH--4e- =4H2O +N2↑。
【解析】:(1)氮原子的L层是第二层,该层上的电子数为5;(2)根据题目给出的反应物和部分生成物,分析反应中的化合价变化,NH3转化为N2H4时化合价由-3升高到-2,故NaClO中的氯元素化合价只能下降到-1,可知产物中有NaCl,再结合元素守恒可知一定有水生成,故可表示为:2NH3+NaClO=N2H4+ NaCl +H2O;(3)分析题给方程式,可知由2×②-①得到要求的热化学方程式,故△H=2△H2-△H1,写出结果:2N2H4(l)+ N2O4(l)=3 N2(g)+ 4H2O(g) △H=-1048.9kJ /mol;(4)碱性电池中负极反应是还原反应,也就是还原剂失电子的反应,结合电解质溶液为碱性条件,故写为:N2H4+ 4OH--4e- =4H2O +N2↑。
【考点定位】此题以氮元素为载体,综合考查了电子层排布、化学方程式书写、盖斯定律的应用、原电池中电极反应式的书写等知识。


科目:高中化学 来源:2013-2014上海市宝山区高二年级化学学科质量监测化学试卷(解析版) 题型:推断题
乙炔是一种重要的基本有机原料,在一定条件下其衍变关系如下图:

已知,B是一种塑料,75%的D溶液在医药上用作消毒剂。试回答下列问题:
49. 比乙炔多一个碳原子的同系物的结构简式是 。
50. A物质的结构简式是 。
51. 写出C→D反应的化学方程式 。
52. A→B反应类型是 。
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(重庆卷解析版) 题型:选择题
(6分)(2012?重庆)对实验:①中和滴定、②中和热的测定、③实验室制备乙烯、④乙酸乙酯的制取,叙述正确的是( )
A.①④必须加热 B.②③必须隔热 C.①②必须用指示剂 D.③④必须用催化剂
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(海南卷解析版) 题型:推断题
化合物A是合成天然橡胶的单体,分子式为C5H8。A的一系列反应如下(部分反应条件略去):

回答下列问题:
(1)A的结构简式为 ,化学名称是 ;
(2)B的分子式为 ;
(3)②的反应方程式为 ;
(4)①和③的反应类型分别是 , ;
(5)C为单溴代物,分子中有两个亚甲基,④的化学方程式为 ;
(6)A的同分异构体中不含聚集双烯(C=C=C)结构单元的链状烃还有 种,写出其中互为立体异构体的化合物的结构简式 。
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(海南卷解析版) 题型:选择题
两种盐的固体混合物:①加热时有气体产生,②加水溶解时有沉淀生成,且沉淀溶于稀盐酸。满足上述条件的混合物是
A.BaCl2和(NH4)2SO4 B.AgNO3和NH4Cl
C.FeCl3和NaHCO3 D.KCl和Na2CO3
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(海南卷解析版) 题型:选择题
化学与环境密切相关,下列有关说法正确的是
A.CO2属于大气污染物
B.酸雨是pH小于7的雨水
C.CO2、NO2或SO2都会导致酸雨的形成
D.大气中CO2含量的增加会导致温室效应加剧
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(新课标解析版) 题型:简答题
(14分)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40mol.L-1的盐酸滴定,滴至终点时消耗盐酸25.0mL。计算该样品中氯的物质的量,并求出FeClx中x值:
(列出计算过程);
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe):n(Cl)=1:2.1,则该样品中FeCl3的物质的量分数为 。在实验室中,FeCl2可用铁粉和 盐酸反应制备,FeCl3可用铁粉和 反应制备;
(3)FeCl3与氢碘酸反应时可生成棕色物质,该反应的离子方程式为
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为
与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为 ,该电池总反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2012年普通高等学校招生全国统一考试化学(大纲全国解析版) 题型:选择题
反应 A+B→C(△H<0)分两步进行 ①A+B→X (△H>0)②X→C(△H<0)下列示意图中,能正确表示总反应过程中能量变化的是( )
A.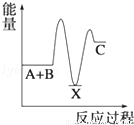 B.
B.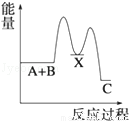 C.
C.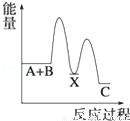 D.
D.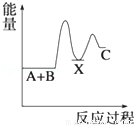
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com