
科目:高中化学 来源: 题型:阅读理解
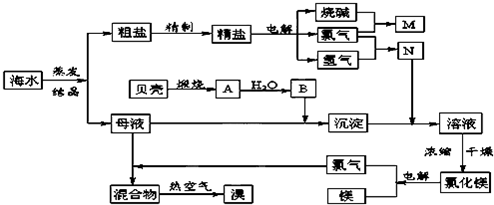
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:天津市青光中学2010-2011学年高一上学期期中考试化学试题 题型:022
| |||||||||||||||||||||||||||||
查看答案和解析>>
科目:高中化学 来源:学习周报 化学 人教课标高二版(选修4) 2009-2010学年 第15期 总第171期 人教课标版(选修4) 题型:022
目前工业上主要采用离子交换膜法电解饱和食盐水,制得
Cl2和H2,并以获取的气体来生产盐酸.将电解后所得的Cl2和H2按一定体积比,按下图所示流程即可合成质量分数为36.5%的盐酸.(1)写出电解饱和食盐水的化学方程式:________.
(2)已知上述条件下食盐的溶解度为36.5 g,则该温度下饱和食盐水溶质的质量分数为________.
(3)设每台电解槽平均每天消耗2.3×104 mol食盐,电解生成的Cl2与H2按体积比1∶1.15通入合成塔,不考虑各阶段的物料损耗,理论上可生产36.5%的盐酸________t.
查看答案和解析>>
科目:高中化学 来源: 题型:
![]()
![]()
图2-3-4
(1)写出电解饱和食盐水的化学方程式________________________________________。
(2)已知工艺条件下食盐的溶解度为36.5 g,则该温度下饱和食盐水溶质的质量分数为__________。
(3)设每台电解槽平均每天消耗2.3×104 mol食盐,电解生成的氯气与氢气按体积比1∶1.15通入合成炉,不考虑各阶段的物料损耗,理论上可生产36.5%的盐酸__________t。
(4)氯气与氢气以1∶a(a>1)通入合成炉,设该厂每天消耗食盐c t,不考虑各阶段的物料损耗,则每天生产36.5%的盐酸__________b t。b=__________t。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com