
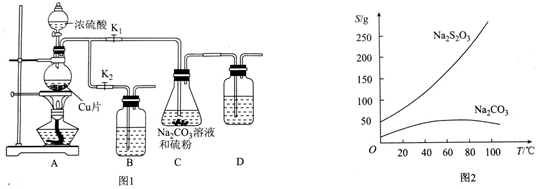
分析 (1)B和D是为了吸收多余的二氧化硫,可以用NaOH溶液吸收;把硫研细,增大接触面积,加快反应速率,S微溶于酒精,所以C中的硫粉应事先研细并用乙醇润湿,否则会降低反应速率;
(2)烧瓶内铜与浓硫酸在加热条件下反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;
(3)防止SO2过量,溶液呈现酸性,导致生成的Na2S2O3分解;
(4)从滤液中获得Na2S2O3•5H2O时,不能直接加热蒸干,否则无法获得Na2S2O3•5H2O,需要通过蒸发浓缩、冷却结晶的操作方法;
(5)取少量产品溶于足量稀盐酸,再利用氯化钡溶液检验是否含有了酸根离子;
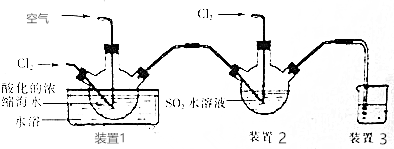
(6)漂白粉的有效成分是次氯酸根,次氯酸根检验强氧化性,可以将碘离子氧化得碘单质,自身被还原为氯离子;
(7)根据Cl2~I2~2Na2S2O3计算余氯量,动作不迅速,空气中的氧气在酸性条件下可把碘离子氧化生成单质碘,消耗硫代硫酸钠的体积会增大.
解答 解:(1)B和D是为了吸收多余的二氧化硫,所以装的是NaOH溶液;把硫研细,增大接触面积,加快反应速率,S微溶于酒精,所以C中的硫粉应事先研细并用乙醇润湿,否则会降低反应速率,
故答案为:NaOH溶液;降低反应速率;
(2)打开K1、关闭K2,向圆底烧瓶中加入足量浓硫酸并加热,烧瓶内生成二氧化硫气体,发生反应的化学方程式为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;
(3)SO2过量,溶液呈现酸性,导致生成的Na2S2O3分解,
故答案为:防止SO2过量,溶液呈现酸性,导致生成的Na2S2O3分解;
(4)从滤液中获得Na2S2O3•5H2O,不能直接蒸干,需要经过蒸发浓缩、冷却结晶、过滤、洗涤、烘干等操作,
故答案为:蒸发浓缩;冷却结晶;
(5)检验样品中是否含有硫酸钠的方案为:取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质,
故答案为:取少量产品溶于足量稀盐酸,静置,取上层清液(或过滤,取滤液),滴加BaCl2溶液,若出现沉淀则说明含有Na2SO4杂质;
(6)漂白粉的有效成分是次氯酸根,次氯酸根检验强氧化性,可以将碘离子氧化得碘单质,自身被还原为氯离子,反应离子方程式为:ClO-+2I-+2H+=Cl-+I2+H2O,
故答案为:ClO-+2I-+2H+=Cl-+I2+H2O;
(7)根据Cl2~I2~2Na2S2O3,可知n(Cl2)=$\frac{1}{2}$n(Na2S2O3)=$\frac{1}{2}$×V×10-3L×Cmol/L,氯气质量为=$\frac{1}{2}$×V×10-3L×Cmol/L×71g/mol=3.55VC×10-2g=35.5VC mg,故余氯量(以游离Cl2计算)为 $\frac{35.5VCmg}{0.1L}$=355VC mg/L;
动作不迅速,空气中的氧气在酸性条件下可把碘离子氧化生成单质碘,消耗硫代硫酸钠的体积会增大,所以结果偏高,
故答案为:355VC;偏高.
点评 本题考查制备方案的设计,题目难度中等,涉及对操作的分析评价、尾气吸收、方程式的书写、离子的检验、化学计算等知识,明确实验原理为解答关键,试题知识点较多、综合性较强,充分考查了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏水 | B. | 糖水 | C. | 水银 | D. | 水晶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 氢化物 | A | B | HF | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | -33.35 | -164 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com