
分析 根据n=cV计算出10.0mL1.0mol/L的H2SO4溶液中硫酸的物质的量,稀释、蒸发过程中溶质硫酸的物质的量不变,根据c=$\frac{n}{V}$分别计算出稀释至500mL、蒸发至2.40mL时硫酸的物质的量浓度.
解答 解:10.0mL1.0mol/L的H2SO4溶液中含有硫酸的物质的量为:1.0mol/L×0.01L=0.01mol,
将原溶液加水稀释至500mL,稀释过程中硫酸的物质的量不变,则所得H2SO4溶液的浓度为:$\frac{0.01mol}{0.5L}$=0.02mol/L,
蒸发浓缩,使溶液的体积变为2.40mL,蒸发过程中硫酸的物质的量不变,则所得溶液的浓度为:$\frac{0.01mol}{0.0024L}$≈4.2mol/L,
故答案为:0.02;4.2.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确稀释、蒸发过程中溶质的物质的量不变为解答关键,注意掌握明确物质的量浓度的概念及表达式,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/g | 8.8 | 17.6 | 22.0 |
| 气体体积/L | 2.24 | 4.48 | 4.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 g石墨和C60的混合物中质子总数为6NA | |
| B. | 常温下,4g 14CH4含有NA个C-H共价键 | |
| C. | 25℃时,pH=12的1.0 L NaClO溶液中水电离出的OH-的数目为0.01NA | |
| D. | 0.1 mol•L-1 Na2CO3溶液中含有0.1NA个CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从1L 1 mol•L-1的氯化钠溶液中取出10ml,其浓度仍是1 mol•L-1 | |
| B. | 物质的量是指物质所含微粒的数目 | |
| C. | 0.5 L 2 mol•L-1的氯化钡溶液中,钡离子和氯离子总数为3×6.02×1023 | |
| D. | 冰水混合物既是纯净物又是化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
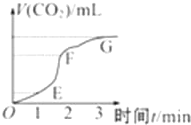 用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:
用纯净的碳酸钙与稀盐酸反应制取二氧化碳气体,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com