
某温度时,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中发生可逆反应生成气体Z,充分反应后X2的浓度为0.4 mol·L-1,Y2的浓度为0.8 mol·L-1,生成的Z的浓度为0.4 mol·L-1,则该反应的化学方程式(Z用X、Y表示)是( )
A.X2+2Y2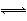 2XY2B.2X2+Y2
2XY2B.2X2+Y2 2X2Y
2X2Y
C.X2+3Y2 2XY3D.3X2+Y2
2XY3D.3X2+Y2 2X3Y
2X3Y
科目:高中化学 来源:2014年高二化学苏教版选修2 1专题综合检测练习卷(解析版) 题型:选择题
下列溶液中加入肥皂水(澄清的),振荡后,不产生沉淀而且有大量泡沫的是( )。
A.光卤石溶液 B.地下水 C.海水 D.雨水
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 7化学平衡状态的建立及标志练习卷(解析版) 题型:填空题
下列可以证明H2(g)+I2(g)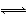 2HI(g)已达平衡状态的是 。
2HI(g)已达平衡状态的是 。
①单位时间内生成n mol H2的同时,生成n mol HI
②一个H—H键断裂的同时有两个H—I键断裂
③百分含量w(HI)=w(I2)
④反应速率v(H2)=v(I2)=v(HI)
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1
⑥温度和体积一定时,生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 6影响化学反应速率的因素练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.Fe和Mg与0.1 mol·L-1的盐酸反应,反应速率相同
B.0.1 mol·L-1的盐酸与0.1 mol·L-1H2SO4分别与大小、形状相同的大理石反应,反应速率相同
C.催化剂能降低分子活化时所需能量,使单位体积内活化分子百分数大大增加
D.100 mL 2 mol·L-1的盐酸与锌片反应,加入适量的NaCl溶液,反应速率不变
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 5化学反应速率练习卷(解析版) 题型:填空题
某温度时,在2 L容器中,某一反应中A、B的物质的量随时间变化的曲线如下图所示,由图中数据分析得:
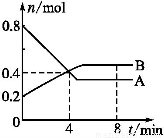
(1)在4 min末时,A、B的物质的量浓度c(A) c(B),从0~4 min内A、B的物质的量浓度变化量Δc(A) Δc(B)(以上填“>”“<”或“=”)。
(2)从反应开始至4 min时,A的平均反应速率为 。
(3)该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 4化学反应热的计算练习卷(解析版) 题型:填空题
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成水蒸气和氮气,放出256.652 kJ的热量。
(1)反应的热化学方程式为 _________________________。
(2)已知H2O(l) H2O(g) ΔH=+44 kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
H2O(g) ΔH=+44 kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
___________________________________。
(4)发射卫星可用肼为燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:
N2(g)+2O2(g) 2NO2(g) ΔH=+67.7 kJ·mol-1
2NO2(g) ΔH=+67.7 kJ·mol-1
N2H4(g)+O2(g) N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
肼和二氧化氮反应的热化学方程式为 __________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 4化学反应热的计算练习卷(解析版) 题型:选择题
在298 K、100 kPa时,已知:
2H2O(g) 2H2(g)+O2(g) ΔH1
2H2(g)+O2(g) ΔH1
Cl2(g)+H2(g) 2HCl(g) ΔH2
2HCl(g) ΔH2
2Cl2+2H2O(g) 4HCl(g)+O2(g) ΔH3
4HCl(g)+O2(g) ΔH3
则ΔH3与ΔH2和ΔH1之间的关系正确的是( )
A.ΔH3=ΔH1+2ΔH2B.ΔH3=ΔH1+ΔH2
C.ΔH3=ΔH1-2ΔH2D.ΔH3=ΔH1-ΔH2
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 2中和反应反应热的测定练习卷(解析版) 题型:选择题
将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是( )
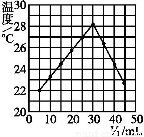
A.做该实验时环境温度为22 ℃
B.该实验表明化学能可以转化为热能
C.NaOH溶液的浓度约为1.00 mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源:2014年高二化学人教版选修四 19一次电池 二次电池练习卷(解析版) 题型:填空题
化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍镉(Ni Cd)电池,其电池总反应可以表示为:
Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是( )
①以上反应是可逆反应
②以上反应不是可逆反应
③充电时化学能转变为电能
④放电时化学能转变为电能
A.①③B.②④C.①④D.②③
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com