
��5�֣����ܱ������У����ϳɰ��ķ�ӦN2+3H2===2NH3������Ӧ�Ƿ��ȷ�Ӧ���ﵽƽ��ʱ���ı����µ�һЩ������
| A�����£� | B����ѹ�� | C����ѹ�� | D������c��H2������E����Сc��NH3������F������c��NH3������ƽ�������ƶ��á� ��������ƽ�������ƶ��á�������ʾ����ֵ�����á�������ʾ����ֵ��С�á�������ʾ��������±��и���ı仯������ڸı�������Ŀ��������Ӧ�ı�ţ�ÿ��ֻ�ı�һ���������� |
| ��� | �ı����� | ƽ���ƶ����� | N2��ת���� | C��NH3�� | C��N2�� | C��H2�� |
| �� | | �� | �� | �� | �� | �� |
| �� | | �� | �� | �� | �� | �� |
| �� | | �� | �� | �� | �� | �� |
| �� | | �� | �� | �� | �� | �� |
| �� | | �� | �� | �� | �� | �� |

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
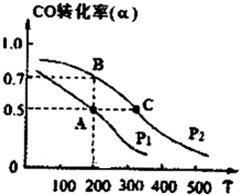 ��2013?�Ͳ�һģ�������û�ѧ��Ӧԭ�������֪ʶ�о�Ԫ�ؼ��仯��������ʣ�
��2013?�Ͳ�һģ�������û�ѧ��Ӧԭ�������֪ʶ�о�Ԫ�ؼ��仯��������ʣ�| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
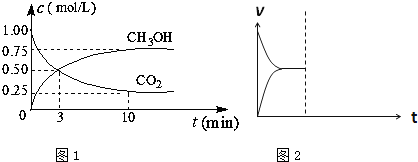
| ���� |
| �¶�/k CO2ת����% |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�꽭��ʡ�������������߶���ѧ�����п��Ի�ѧ�Ծ����������� ���ͣ������
��14�֣�CO2��ת�����л���ʵ��̼ѭ����
��1�������Ϊ1 L���ܱ������У�����1 mol CO2��3 mol H2��һ�������·�����Ӧ�� CO2(g)+3H2(g) CH3OH(g)+H2O(g) ��H=��49.0 mol��L-1�����CO2��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
CH3OH(g)+H2O(g) ��H=��49.0 mol��L-1�����CO2��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��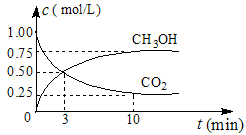
�ٴ�0 min��10 min��v(H2)= mol��(L��min)-1��
����˵��������Ӧ�ﵽƽ��״̬���� ��ѡ���ţ���
A����Ӧ��CO2��CH3OH�����ʵ���Ũ��֮��Ϊ1�U1����ͼ�н���㣩
B�������������ѹǿ����ʱ��ı仯���仯
C����λʱ����ÿ����3 mol H2��ͬʱ����1 mol H2O
D��CO2����������ڻ�������б��ֲ���
�����д�ʩ����ʹn (CH3OH)/n (CO2)������� ��ѡ���ţ���
A����H2O(g)����ϵ�з��� B�����º��ݳ���He
C�����º�ѹ����He D�����º����ٳ���1 mol CO2��3 mol H2
��2���ݱ�����һ���������ɶ�����̼�������ϳɶ������ѳ�Ϊ��ʵ��
2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
��һ��ѹǿ�£���÷�Ӧ��ʵ���������±���
�����������ݻش��������⣺
�ٷ�Ӧ���¶����ߣ�Kֵ �����������С�����䡱����
�������̼��[n��H2��/n��CO2��], Kֵ �����������С�����䡱����
��3��800��ʱ��C(s)��CO2(g) 2CO(g)��ƽ�ⳣ��K��1.64����ͬ�����²��c(CO)��0.20 mol��L��1��c(CO2)��0.05 mol��L��1����ʱ��Ӧ�� ����������桱��������С�
2CO(g)��ƽ�ⳣ��K��1.64����ͬ�����²��c(CO)��0.20 mol��L��1��c(CO2)��0.05 mol��L��1����ʱ��Ӧ�� ����������桱��������С�
��4�����ܱ�������ͨ��1mol H2��1mol CO2����H2(g)+CO2(g)  CO(g)+H2O(g) ��H> 0��Ӧ������Ӧ�ﵽƽ�����������������ʱ���������¶ȣ�������ͼ�л�����(v��)����(v��)��Ӧ������ʱ��t�仯��ʾ��ͼ��
CO(g)+H2O(g) ��H> 0��Ӧ������Ӧ�ﵽƽ�����������������ʱ���������¶ȣ�������ͼ�л�����(v��)����(v��)��Ӧ������ʱ��t�仯��ʾ��ͼ��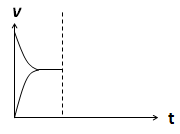
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
��13�֣�����ѧ����̼���ȡ�����ѧʽCOCl2������Ϣ�Զ���֮һ��
2-1 ������ѧ���ʻ��ã�������±�ĵ��ͷ�Ӧ������ˮ�⡢����ʹ��⡣
��1�������������Ҵ���Ӧ���ò���Ļ�ѧ������ ��
��2������������������Ӧ�Ļ�ѧ����ʽ ��
��3����������AlCl3�����������������Ӧ���ò���Ľṹ��ʽ ��
��4�������뱽����������Ӧ�ɵ������ᱽ�����м����Ľṹ��ʽ�� �������ᱽ���Ľṹ��ʽ�� ��
2-2 ʵ���ҿ������Ȼ�̼�ͷ������ᣨH2SO4?SO3����Ӧ�Ʊ�������д����ѧ����ʽ��
2-3 BTC��һ���ȶ��İ�ɫ�ᾧ�壬�۵�Ϊ78��82�棬�е�Ϊ203��206�档1mol BTC����һ�������·ֽ����3mol�����������ֱ���Ϊ��������������ҵ�Ͽ�������̼����������ȴ���Ӧ�Ʊ�BTC��BTC�ķ�Ӧ������������ƣ����Ժʹ���ȩ���������������ᡢ�ӡ��ǰ��ȶ��ֻ����ﷴӦ����˵Ͷ��Ե�BTC�ڻ�ѧ��Ӧ����ȫ������綾�������ã��Ĺ����ϳ���صĻ�����Ʒ��
��1��BTC������������ԭ�Ӷ��ȼۣ���д���ṹ��ʽ
��2���������⣬BTC�ȹ�������ʲô�ŵ㣿
2-4 2004��6��15�ո���ʡ���ʽṹ�о���������ﹹ����һ������ҵ����ʵ�������������ж�����й©����ɣ���������260������ҽԺ���Ρ��������Ȱ�����ʽ�ֽ⣺COCl2(g)��CO(g)��Cl2(g)��Kp��4.44��10��2��668K��KΪ��ƽ�ⳣ���������ܱ������У������������ѹ��Ϊ300kPaʱ������û�������ƽ����������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com