
分析 X、Y、Z三种元素的离子结构都和Ar具有相同的电子层排布,H2在X单质中燃烧,产生苍白色火焰,则X是Cl元素;Y元素的气态氢化物是H2Y,则Y位于第VIA族,其离子结构和氩原子电子层结构相同,所以Y是S元素,最高价氧化物为SO3中硫的质量分数为40%;Z元素和N元素在同一族,则Z为P元素.
解答 解:X、Y、Z三种元素的离子结构都和Ar具有相同的电子层排布,H2在X单质中燃烧,产生苍白色火焰,则X是Cl元素;Y元素的气态氢化物是H2Y,则Y位于第VIA族,其离子结构和氩原子电子层结构相同,所以Y是S元素,最高价氧化物为SO3中硫的质量分数为40%;Z元素和N元素在同一族,则Z为P元素.
(1)X的元素符号为Cl,Z的最高价氧化物的水化物的化学式为:H3PO4,
故答案为:Cl;H3PO4;
(2)Y的最高价氧化物的水化物为H2SO4,与氢氧化铝反应的离子方程式:Al(OH)3+3H+=Al3++3H2O,
故答案为:Al(OH)3+3H+=Al3++3H2O.
点评 本题位置结构性质关系的相互应用,熟悉原子结构及物质的性质是解本题关键,根据反应现象、原子结构确定元素,再结合元素化合物的性质来分析解答.


科目:高中化学 来源: 题型:选择题
| A. | 在pH=1的溶液中:K+、Na+、SO42-、HCO3- | |
| B. | 在0.1 mol•L-1 Na2CO3溶液中:Al3+、K+、NO3-、SO42- | |
| C. | 在0.1 mol•L-1 FeCl3溶液中:K+、NH4+、I-、SCN- | |
| D. | 在pH=12的溶液中:K+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的电子式为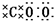 | |
| B. | 所有的主族元素的简单离子的化合价与其族序数相等 | |
| C. | NH4Cl晶体中,既含有离子键,又含有共价键 | |
| D. | 下列物质均为极性分子:H2O、NH3、CCl4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热 | B. | 不用稀硫酸,改用98%浓硫酸 | ||
| C. | 将铁片改为镁条 | D. | 不用铁片,改用铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
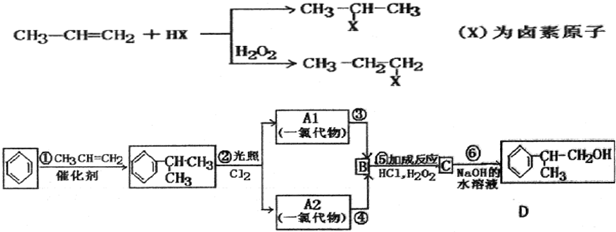
 ;
;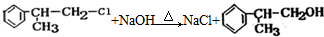 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室制乙烯和实验室制乙炔 | |
| B. | 苯酚制三溴苯酚和乙醛制乙醇 | |
| C. | 乙烯使酸性高锰酸钾溶液褪色和乙醛使溴水褪色 | |
| D. | 乙酸乙酯的水解和乙烯制聚乙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com