
分析 根据n=$\frac{V}{{V}_{m}}$计算出1.12LCO的物质的量及含有原子的物质的量,再根据N=nNA计算出含有的原子数、碳原子数及电子数,据此进行解答.
解答 解:标准状况下,1.12L CO的物质的量为:$\frac{1.12L}{22.4L/mol}$=0.05mol,含有原子的物质的量为:0.05mol×2=0.1mol,含有的原子数为0.1NA,
0.05mol CO中含有0.05molC原子,含有0.05NA个碳原子,
0.05molCO中含有电子的物质的量为:0.05mol×14=0.7mol,含有电子数为0.7NA,
故答案为:0.05;0.1;0.1NA;0.05NA;0.7NA.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与气体摩尔体积、阿伏伽德罗常数之间的关系为解答关键,试题侧重考查学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 加入NaOH,溶液pH升高,c(SO32-)增大 | B. | 氯化钡有两性 | ||
| C. | 两支试管中的白色沉淀都是BaSO4 | D. | SO2具有两性且水溶液有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{11}{15}$ mol | B. | $\frac{2}{5}$mol | C. | $\frac{3}{5}$mol | D. | $\frac{1}{5}$ mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2A(g)+B(g)═2C(l)△H=+Q3 kJ•mol-1 | B. | 2A(g)+B(g)═2C(g)△H=+Q2 kJ•mol-1 | ||
| C. | 2A(l)+B(l)═2C(g)△H=+Q1 kJ•mol-1 | D. | 2A(l)+B(l)═2C(l)△H=+Q4 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光束通过该液体时形成光亮的“通路” | |
| B. | 插入石墨电极通直流电后,有一极附近液体颜色加深 | |
| C. | 向该液体中加入硝酸银溶液,无沉淀产生 | |
| D. | 向该液体中逐滴滴入过量的稀硫酸,会看到液体先生成红褐色沉淀,后沉淀溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
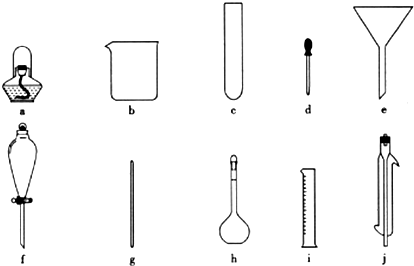
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com