
X、Y、Z、W、Q、R六种短周期主族元素,原子序数依次增大,Z基态原子核外有三个未成对电子,Y、Z、W分别与X形成常见化合物的分子结构依次为正四面体、三角锥形和V形。Q的各级电离能如下表,W与R是同族元素。
| Q | I1 | I2 | I3 | I4 | I5 | … |
| 电离能(kJ/mol) | 496 | 4562 | 6912 | 9543 | 13353 | … |
回答下列有关问题:
(1)W形成单质的晶体类型是_____________;其单核离子结构示意图为_____________。
(2)化合物Q2W2的电子式__________,化合物XYZ的结构式________________。
(3)Y与X形成式量最小,且分子中含有非极性键的分子式__________。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
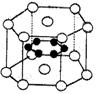
纳米材料的表面微粒数占微粒总数的比例极大,这是它有许多特殊性质的原因.假设某纳米颗粒中粒子分布类似于硼镁化合物,其结构如图所示,则这种纳米颗粒的分子式为( )
A.MgB B.Mg3B6 C.Mg5B12 D.Mg14B6
( 镁原子○位于顶点和上下两个面心,硼原子●位于内部 )
查看答案和解析>>
科目:高中化学 来源: 题型:
人体血液里Ca2+离子的浓度一般采用mg/mL来表示。加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定,使草酸转化成CO2逸出。试回答:
(1)现需要80 mL 0.02 mol·L-1标准KMnO4溶液来进行滴定,则配制溶液时需要的玻璃仪器有烧杯、玻璃棒和______________________;配制时, KMnO4溶液应用强酸酸化,本实验选择________作酸化剂。若选择HNO3酸化,则结果可能________(填“偏大”“偏小”或“不变”)。
(2)草酸与酸性KMnO4溶液反应的离子方程式为_______________________________。
(3)滴定时,根据现象_______________________________________,即可确定反应达到终点。
(4)滴定的实验数据如下所示:
| 实验编号 | 待测血液的体积/mL | 滴入KMnO4溶液的体积/mL |
| 1 | 20.00 | 11.95 |
| 2 | 20.00 | 13.00 |
| 3 | 20.00 | 12.05 |
经过计算,血液样品中Ca2+离子的浓度为________mg/mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
向NaBr、NaI、Na2CO3的混合溶液中通入足量氯气后,将溶液蒸于并充分灼烧,得到固体剩余物的组成可能是
A.NaCl B.NaCl、NaHCO3
C.NaCl、I2 D.NaCl、NaI、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
钠的化合物是中学化学常见物质,结合你掌握的化学知识,下列说法合理的是
A.锌粒与盐酸反应时,若加入适量氯化钠晶体,可明显加快反应速率
B.氯化钠中所含化学键为离子键,含离子键的化合物一定是离子化合物
C.Na2O2能与水反应,所以Na2O2可以作气体的干燥剂
D.氯化钠溶液导电是化学变化,而熔融态氯化钠导电是物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.煤焦油、石油、花生油都属于烃
B.蛋白质、脂肪、葡萄糖在一定条件下都能水解
C.甲烷、乙烯、苯都可通过石油分馏得到
D.乙醇既能与有机化合物反应又能与无机化合物反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的做法正确的是
A.用pH试纸测氯水的pH
B.用托盘天平称取5.72 g NaCl晶体
C.用酸式滴定管量取20.00 mL的酸性KMnO4溶液
D.用带磨口玻璃塞的试剂瓶保存Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
在一固定容积的密闭容器中充入3 mol A和1 mol B,发生反应:3A(g)+B(g) xC(g),达到平衡后,C的体积分数为w%。若维持容器体积和温度不变,将0.9 mol A、0.3 mol B和2.1 mol C作为起始物质,达到平衡后,C的体积分数仍为w%,则x值可能为( )
xC(g),达到平衡后,C的体积分数为w%。若维持容器体积和温度不变,将0.9 mol A、0.3 mol B和2.1 mol C作为起始物质,达到平衡后,C的体积分数仍为w%,则x值可能为( )
A.1 B.2
C.3 D.任意值
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1) (1)已知AX3的熔点 和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成lmol AX5,放出热量123.8 kJ。该反应的热化学方程式为 。
(2)反应AX3(g)+X2(g) AX
AX 5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。
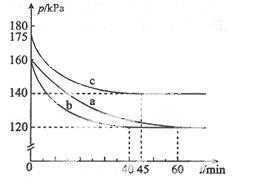
①列式计算实验a从反应开始至达到平衡时的反应速率 v(AX5)= 。
②图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b 、
c 。
③用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为
 ;实验a和c的平衡转化率:αa为 、αc为 。
;实验a和c的平衡转化率:αa为 、αc为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com