
���� ��1������C��s��+H2O��g��?CO��g��+H2��g��֪�������1molH2O�μӷ�Ӧ����Ӧǰ��������������12g��5min��������������ܶ�������0.12g/L�������ӵ�����=0.12g/L��3L=0.36g��������n��H2O��=$\frac{0.36g}{12g}��1mol$=0.03mol��
��H2O��ʾ0��5min��ƽ����Ӧ����=$\frac{\frac{��n}{V}}{��t}$��
��2�����淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ���Ӧ��ϵ�и����ʵ����ʵ��������ʵ���Ũ�ȡ��ٷֺ����Լ��ɴ������һϵ�����������䣻
��3������С���������Ũ���������淴Ӧ���ʶ�����
�ڻ�ѧƽ�ⳣ��ֻ���¶��йأ��÷�Ӧ������Ӧ�����ȷ�Ӧ�������¶�ƽ�ⳣ�����������¶�ƽ�������ƶ���
��4����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-283.0kJ•mol-1��-725.8kJ•mol-1��ˮ��Ħ��������Ϊ44.0 kJ/mol����
��CO��g��+$\frac{1}{2}$O2��g��=CO2��g����H=-283.0kJ•mol-1
��CH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2 H2O��l����H=-725.8kJ•mol-1
��H2O��l��=H2O��g����H=-44KJ/mol
�ɸ�˹���ɿ�֪�â�-��+�ۡ�2�õ��Ȼ�ѧ����ʽ��
��� �⣺��1������C��s��+H2O��g��?CO��g��+H2��g��֪�������1molH2O�μӷ�Ӧ����Ӧǰ��������������12g��5min��������������ܶ�������0.12g/L�������ӵ�����=0.12g/L��3L=0.36g��������n��H2O��=$\frac{0.36g}{12g}��1mol$=0.03mol��
��H2O��ʾ0��5min��ƽ����Ӧ����=$\frac{\frac{��n}{V}}{��t}$=$\frac{\frac{0.03mol}{3L}}{5min}$=0.002mol/��L•min����
�ʴ�Ϊ��0.002mol/��L•min����
��2��A��CO�ĺ������ֲ���ʱ�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬������ȷ��
B����Ӧ�ﵽƽ��״̬ʱ��v����H2O��=v����H2��������ȷ��
C�������л�������ƽ����Է����������ֲ���ʱ�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬������ȷ��
��ѡABC��
��3����3������С���������Ũ���������淴Ӧ���ʶ�����ƽ�������ƶ���ͼ��Ϊ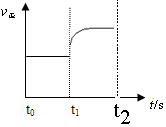 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
�ڻ�ѧƽ�ⳣ��ֻ���¶��йأ��÷�Ӧ������Ӧ�����ȷ�Ӧ�������¶�ƽ�ⳣ�����������¶�ƽ�������ƶ���ͼ��Ϊ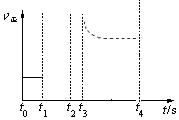 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��4����CO��g����CH3OH��l����ȼ���ȡ�H�ֱ�Ϊ-283.0kJ•mol-1��-725.8kJ•mol-1����
��CO��g��+$\frac{1}{2}$O2��g��=CO2��g����H=-283.0kJ•mol-1
��CH3OH��l��+$\frac{3}{2}$O2��g��=CO2��g��+2 H2O��l����H=-725.8kJ•mol-1
��H2O��l��=H2O��g����H=-44KJ/mol
�ɸ�˹���ɿ�֪�â�-��+�ۡ�2�÷�ӦCH3OH��l��+O2��g��=CO��g��+2 H2O��g�����÷�Ӧ�ķ�Ӧ�ȡ�H=-725.8kJ•mol-1-��-283.0kJ•mol-1��+2��44KJ/mol=-354.8kJ•mol-1��
�ʴ�Ϊ��CH3OH ��l��+O2��g��=CO ��g��+2H2O ��g����H=-354.8 kJ�Mmol��
���� ���⿼���˻�ѧƽ��ļ��㡢��ѧƽ��״̬���жϡ���ѧƽ���Ӱ�����ص�֪ʶ����Ŀ�Ѷ��еȣ���ȷӰ�컯ѧ��Ӧ���ʵ�����Ϊ���ؼ���������ؿ���ѧ���ķ�����������ѧ����������ע�⣨2��Bѡ�ƽ��״̬�´���v����H2O��=v����H2����������v����H2O��=v����H2��ʱ�÷�Ӧ��һ���ﵽƽ��״̬��ע����ߵ�����


 ͬ��������ϰϵ�д�
ͬ��������ϰϵ�д� �ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�
�ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
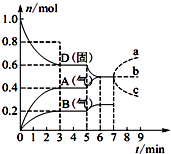 ���ݻ�Ϊ2.0L���ܱ������ڣ�����D��T��ʱ������Ӧ���䷴Ӧ�������������ʵ�����ʱ��t�ı仯��ϵ��ͼ��ʾ��������������ȷ���ǣ�������
���ݻ�Ϊ2.0L���ܱ������ڣ�����D��T��ʱ������Ӧ���䷴Ӧ�������������ʵ�����ʱ��t�ı仯��ϵ��ͼ��ʾ��������������ȷ���ǣ�������| A�� | �ӷ�Ӧ��ʼ����һ�δﵽƽ��ʱ��A���ʵ�ƽ����Ӧ����Ϊ0.066 7 mol/��L•min�� | |
| B�� | �÷�Ӧ�Ļ�ѧ����ʽΪ2D��s��?2A��g��+B��g�����÷�Ӧ��ƽ�ⳣ������ʽΪK=c2��A��•c��B�� | |
| C�� | ��֪��Ӧ�ġ�H��0�����5 minʱͼ����������仯��ԭ�������������ϵ���¶� | |
| D�� | ���ڵ�7 minʱ����D�����ʵ��������ʾA�����ʵ����仯��ȷ����a���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����������������ɫ�����Ϳ�� | |
| B�� | ��������ͨ�ֺͲ�����еĺ�̼�����μ�С | |
| C�� | �轺������ʵ���Һʹ�װʳƷ��ƿװҩƷ�ȵĸ���� | |
| D�� | ��������������Ʒ�Ļ���ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO2��CO������������ѹǿ֮����7��11 | |
| B�� | CO2��CO���ܶ�֮����11��7 | |
| C�� | CO2��CO�ķ�������� | |
| D�� | CO2��CO����ԭ�Ӹ�������22��7 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.15mol•L-1 | B�� | 0.2mol•L-1 | C�� | 0.3mol•L-1 | D�� | 0.4mol•L-1? |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH3-CH=CH-CH3+Br2$��_{��}^{����}$ | |
| B�� | CH2=CH-CH2CH3+HCl | |
| C�� | CH3-CH=CH2+H2O $��_{���ȡ���ѹ}^{����}$ | |
| D�� | CH3CH3+Cl2$\stackrel{����}{��}$ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ͻ�ԭ��������ʵ���֮��Ϊ2��1 | |
| B�� | ת��4 mol����ʱ��ֻ����װ����ͨ��44.8 L H2����״���� | |
| C�� | װҩƷ֮ǰ����װ����100�沢����һ��� | |
| D�� | �Ʊ����⻯�Ƶĸ����������NaH |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
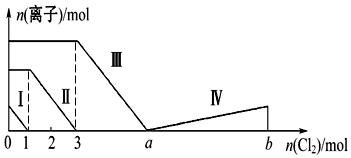
| A�� | �߶��ʾBr-�ı仯��� | B�� | ԭ��Һ��n��FeBr2����n��FeI2��=1��3 | ||
| C�� | �߶���ʾIO3-�ı仯��� | D�� | ����ͼ��������a��ֵ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com