
 由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂.如:
由氧化物经氯化作用生成氯化物是工业生产氯化物的常用方法,Cl2、CCl4是常用的氯化剂.如: ,其中碳氧原子之间共价键是c(填序号):
,其中碳氧原子之间共价键是c(填序号):分析 (1)Cr元素是24号元素,Cr原子形成离子先失去高能层中的电子,结合核外电子排布规律书写;
(2)CCl4分子中C原子成4个C-Cl单键,杂化轨道数目为4,采取sp3杂化;
(3)COCl2俗称光气,分子中C原子采取sp2杂化成键,C原子与氯原子之间形成C-Cl单键,故C原子与O原子之间形成C=O双键,双键中含有1个σ键、1个π键;
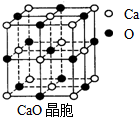
(4)由CaO晶胞结构可知,CaO晶体中每个O2-的周围有6个Ca2+,每个Ca2+的周围有6个O2-,影响晶格能的因素有离子所带电荷与离子半径,据此解答.
解答 解:(1)Cr元素是24号元素,Cr原子的核外电子排布式为1s22s22p63s23p63d54s1,故Cr3+的基态电子排布式为1s22s22p63s23p63d3,
故答案为:1s22s22p63s23p63d3;
(2)CCl4分子中C原子成4个C-Cl单键,杂化轨道数目为4,采取sp3杂化,
故答案为:sp3;
(3)COCl2俗称光气,分子中C原子采取sp2杂化成键,C原子与氯原子之间形成C-Cl单键,故C原子与O原子之间形成C=O双键,光气分子的结构式是 ,C=O双键中含有1个σ键、1个π键,
,C=O双键中含有1个σ键、1个π键,
故答案为: ,c;
,c;
(4)由CaO晶胞结构可知,CaO晶体中每个O2-的周围有6个Ca2+,每个Ca2+的周围有6个O2-,导致两者晶格能差异的主要原因是CaO晶体中离子的电荷数大于NaCl晶体中离子的电荷,
故答案为:6,CaO晶体中离子的电荷数大于NaCl晶体中离子的电荷.
点评 本题主要考查核外电子排布规律、杂化轨道、化学键与晶胞结构等,难度不大,注意原子形成阳离子时先失去高能层中高能级的电子.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | CaCl2易吸收空气中的水分 | |
| B. | Ca(ClO)2见光易分解 | |
| C. | Ca(ClO)2与空气中的水分和二氧化碳作用,生成HClO | |
| D. | Ca(ClO)2易被空气中的氧气氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
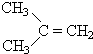 $→_{Zn/H_{2}O_{2}}^{O_{3}}$
$→_{Zn/H_{2}O_{2}}^{O_{3}}$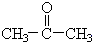 +
+ 据以上线索和下列反应事实,确定C7H14的结构和名称:C7H14$→_{Zn/H_{2}O_{2}}^{O_{3}}$CH3CHO+
据以上线索和下列反应事实,确定C7H14的结构和名称:C7H14$→_{Zn/H_{2}O_{2}}^{O_{3}}$CH3CHO+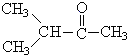
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用电子式表示氯化氢分子的形成过程: | |
| B. | 硫离子结构示意图: | |
| C. | 氢氧根的电子式: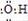 | |
| D. | HClO的结构式:H-O-Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物 干冰 SO2 | B. | 碱 苛性钠 NaOH | ||
| C. | 盐 钡餐 BaCO3 | D. | 单质 氯水 Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第二周期中,最高价含氧酸酸性最强的是氟 | |
| B. | 碘的非金属性比氯弱 | |
| C. | VA族中原子半径最小的是氮 | |
| D. | 钠的金属性比锂强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 装置Ⅰ在反应过程中自始至终只生成红棕色气体 | |
| B. | 装置Ⅱ开始阶段铁丝只发生析氢腐蚀 | |
| C. | 装置Ⅱ在反应过程中能产生氢气 | |
| D. | 装置Ⅰ在反应结束时溶液中的金属阳离子只有Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中所有原子都在同一平面内 | |
| B. | 能与溴水发生加成反应使其褪色 | |
| C. | 能与浓HNO3在一定条件下发生取代反应 | |
| D. | 能与酸性KMnO4溶液反应使其褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com