
| A. | 6.4g | B. | 9.6g | C. | 19.2g | D. | 24g |
分析 Cu和浓硝酸反应过程中,Cu失电子生成铜离子、硝酸得电子生成NO2、N2O4、NO,且转移电子守恒,这些气体若与1.12LO2(标况)混合后通入水中,气体被完全吸收,说明氧气得到的电子等于这些气体生成硝酸根离子得到的电子,所以氧气得到的电子等于Cu失去的电子,根据转移电子守恒得到硝酸铜的物质的量,再根据离子方程式计算加入稀硫酸后溶解的Cu.
解答 解:Cu和浓硝酸反应过程中,Cu失电子生成铜离子、硝酸得电子生成NO2、N2O4、NO,且转移电子守恒,这些气体若与2.24LO2(标况)混合后通入水中,气体被完全吸收,说明氧气得到的电子等于这些气体生成硝酸根离子得到的电子,所以氧气得到的电子等于Cu失去的电子,根据转移电子得n(Cu)=$\frac{\frac{1.12L}{22.4L/mol}×4}{2}$=0.1mol,根据原子守恒得n(Cu)=n[Cu(NO3)2]=0.1mol,再加入稀硫酸后,相当于溶液中含有硝酸,能继续溶解Cu,n(H+)=2n(H2SO4)=2×5mol/L×0.1L=1mol,n(H+):n(NO3- )=1mol:0.2mol=5:1>$\frac{1}{4}$,所以氢离子有剩余,根据硝酸根离子计算溶解铜的质量,
设溶解Cu的质量为x,
3Cu+2NO3-+8H+=3Cu2++2NO+4H2O
192g 2mol
x 0.2mol
192g:2mol=x:0.2mol
x=$\frac{192g×0.2mol}{2mol}$=19.2g,
故选:C.
点评 本题考查根据方程式的计算,明确物质之间的反应是解本题关键,注意进行过量计算,注意转移电子守恒、原子守恒的利用,题目难度中等.


科目:高中化学 来源: 题型:填空题
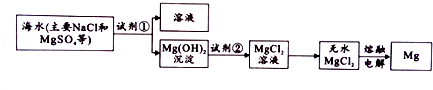
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由分子组成的物质中一定存在共价键 | |
| B. | 全部由非金属元素组成的化合物不一定是共价化合物 | |
| C. | 只有在双原子单质分子中,相同的非金属原子之间才能形成化学键 | |
| D. | 两个非金属原子间可能形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铁与盐酸反应:H++OH-═H2O | |
| B. | Ca(HCO3)2溶于稀盐酸中:CO32-+2H+═CO2↑+H2O | |
| C. | 铁与H2SO4反应:Fe+2H+═Fe3++H2↑ | |
| D. | 澄清的石灰水与醋酸反应:OH-+CH3COOH═CH3COO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中:Na+、NH4+、S2-、CO32- | |
| B. | 空气中:NO、SO2、H2S、HCl | |
| C. | Fe(OH)3胶体中:Na+、Ag+、Br-、NO3 | |
| D. | 能使甲基橙变红的溶液中:Fe2+、Al3+、SO42-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H(${\;}_{1}^{1}$H),D(${\;}_{1}^{2}$H),T(${\;}_{1}^{3}$H)表示三种氢原子 | |
| B. | 原子最外层少于4个电子的元素均是金属元素 | |
| C. | 稀有气体元素最外层电子数均为8个 | |
| D. | 目前人们已发现了5000多种核素,说明发现了5000多种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y两元素最简单氢化物的稳定性:X<Y | |
| B. | Z、W的氧化物均能与稀硫酸反应 | |
| C. | Z和W的氧化物均可作耐高温材料 | |
| D. | W的单质可用于制备光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
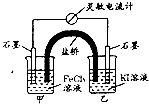 控制合适的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列说法不正确的是( )
控制合适的条件,将反应2Fe3++2I-?2Fe2++I2设计成如图所示的原电池.下列说法不正确的是( )| A. | 盐桥中的K+移向FeCl3溶液 | |
| B. | 反应开始时,乙中石墨电极上发生氧化反应 | |
| C. | 电流计读数为零时,反应达到化学平衡状态 | |
| D. | 电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电级为负极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com