
分析 A、C均为常见的单质,B、D为常见的化合物,它们在一定条件下有如下转化关系:A+B-→C+D,反应类型为置换反应,
(1)若A、C均为生活中常见金属,D既能与盐酸,又能与氢氧化钠溶液反应,判断D为两性物质为Al2O3,推断A为Al,C为Fe,B为氧化铁,发生的是铝热反应2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,该反应为放热反应;
(2)若A、C分别是由原子序数相差8的非金属元素组成的固体单质发生的置换反应,结合所学判断可以判断是同主族的非金属单质间的反应,是碳和二氧化硅反应生成硅和一氧化碳的反应,标注元素化合价变化结合化学方程式定量关系计算氧化剂和还原剂反应的物质的量之比;
(3)若组成A单质的元素形成的带两个正电荷的阳离子具有与氖原子相同的电子层结构,判断为Mg2+,判断为A为金属镁,且C为黑色固态单质判断为C,推断是没在二氧化碳中燃烧发生的置换反应,根据产物判断化学键类型.
解答 解:A、C均为常见的单质,B、D为常见的化合物,它们在一定条件下有如下转化关系:A+B-→C+D,反应类型为置换反应,
(1)若A、C均为生活中常见金属,D既能与盐酸,又能与氢氧化钠溶液反应,判断D为两性物质为Al2O3,推断A为Al,位于第三周期第ⅢA族,C为Fe,B为氧化铁,发生的是铝热反应,反应方程式为 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,该反应为放热反应,故反应物总能量高于生成物总能量,
故答案为:第三周期第ⅢA族; 2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;大于;
(2)若A、C分别是由原子序数相差8的非金属元素组成的固体单质发生的置换反应,结合所学判断可以判断是同主族的非金属单质间的反应,是碳和二氧化硅反应生成硅和一氧化碳的反应,化学方程式为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$ Si+2CO↑,C元素化合价升高做还原剂,二氧化硅做氧化剂,氧化剂和还原剂反应的物质的量之比为1:2,
故答案为:2C+SiO2$\frac{\underline{\;高温\;}}{\;}$ Si+2CO↑;1:2;
(3)若组成A单质的元素形成的带两个正电荷的阳离子具有与氖原子相同的电子层结构,判断为Mg2+,判断为A为金属镁,且C为黑色固态单质判断为C,推断是没在二氧化碳中燃烧发生的置换反应,化学方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,B为二氧化碳,存在共价键,D为氧化镁,存在离子键,
故答案为:2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C;共价键;离子键.
点评 本题考查了物质性质的分析应用,主要是物质转化关系的理解应用,掌握基础是解题关键,题目难度中等.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:实验题
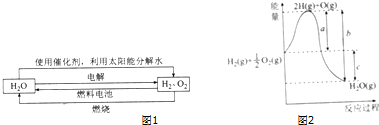 科学家认为氢气是一种高效且无污染的理想能源,近20年来,以氢气为未来的动力燃料的研究获得了迅速发展.
科学家认为氢气是一种高效且无污染的理想能源,近20年来,以氢气为未来的动力燃料的研究获得了迅速发展.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ①③④⑤ | C. | ②④⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,W与R形成的化合物的化学式为Na3N.它们的晶体属于离子晶体.
,W与R形成的化合物的化学式为Na3N.它们的晶体属于离子晶体.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蚕丝、羊毛、棉花的主要成分都是蛋白质 | |
| B. | 纤维素、油脂、蛋白质都能水解,但水解产物不同 | |
| C. | 油脂在碱的催化作用下可发生水解,工业上利用该反应生产肥皂 | |
| D. | 乙酸乙酯中的少量乙酸可用饱和Na2CO3溶液除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏和煤的干馏都是物理变化 | |
| B. | 油脂、淀粉、纤维素都是高分子化合物 | |
| C. | 酯类物质是形成水果香味的主要成分 | |
| D. | 纤维素和淀粉互为同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室可用电石与蒸馏水制乙炔 | |
| B. | 苯与液溴反应时,要加入铁粉,所以真正起到催化作用的是铁粉 | |
| C. | 石油裂化的目的是为了提高汽油的产量和质量 | |
| D. | 说明苯分子中的碳碳键不是单、双键交替的事实是苯的邻位二取代物只有一种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com