
| A. | 乙烷 | B. | 丙烯 | C. | 丁炔 | D. | 甲苯 |
分析 相同质量烃CxHy燃烧耗氧量规律:氢的质量分数越大,完全燃烧耗氧越多.即$\frac{y}{x}$越大,耗氧量越大,据此判断.
解答 解:A、乙烷C2H6,H原子与C原子个数比为3:1;
B、丙烯C3H6,H原子与C原子个数比为6:3=2:1;
C、丁炔C4H6,H原子与C原子个数比为6:4=3:2;
D、甲苯C7H8,H原子与C原子个数比为8:7;
所以H原子与C原子个数比关系为:C2H6>C3H6>C4H6>C7H8.
所以相同质量的各烃乙烷的燃烧耗氧量最大.
故选:A.
点评 本题考查烃的燃烧耗氧量计算,难度不大,注意规律的归纳总结.相同质量烃CxHy燃烧耗氧量规律:氢的质量分数越大,完全燃烧耗氧越多.


科目:高中化学 来源: 题型:解答题
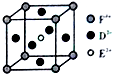 A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):
A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):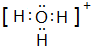 .
. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锌粒与稀 HNO3反应制备 H2 | B. | 加热分解 NH4Cl 固体制 NH3 | ||
| C. | 大理石与稀 H2SO4反应制备 CO2 | D. | 亚硫酸钠与浓 H2SO4反应制备 SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
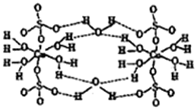 已知铜元素能形成多种化合物.
已知铜元素能形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 增加Fe粉的用量 | |
| B. | 充入Ar,保持容器内体积不变 | |
| C. | 保持容器体积不变,增加水蒸气输入量 | |
| D. | 充入Ar,保持容器内压强不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com