
 ��1��������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�����ȼ����ֵ�ߣ�ʵ���ã��ڳ��³�ѹ�£�1gH2��ȫȼ������Һ̬ˮ���ų� 142.9kJ ���������ܱ�ʾH2��ȼ���ȵ��Ȼ�ѧ����ʽΪ
��1��������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϣ�����ȼ����ֵ�ߣ�ʵ���ã��ڳ��³�ѹ�£�1gH2��ȫȼ������Һ̬ˮ���ų� 142.9kJ ���������ܱ�ʾH2��ȼ���ȵ��Ȼ�ѧ����ʽΪ| 1 |
| 2 |
| 1 |
| 2 |
| ||
| 4 |
| (2amol/L) 2 |
| (amol/L)?(amol/L)3 |
| 4 |
| a2 |
| 4 |
| a2 |
| a |
| 2 |
| n |
| V |
| n(�����) | ||
|
| ||||
|
| 500a�� |
| 40a+b |
| 500a�� |
| 40a+b |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
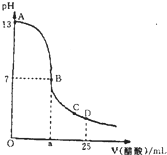 �����£���25mL 0.1mol/L NaOH��Һ����μ���0.2mol/L CH3COOH��Һ��������ͼ������������Һ���ʱ������仯���й�����Ũ�ȱȽϻ�˵����ȷ���ǣ�������
�����£���25mL 0.1mol/L NaOH��Һ����μ���0.2mol/L CH3COOH��Һ��������ͼ������������Һ���ʱ������仯���й�����Ũ�ȱȽϻ�˵����ȷ���ǣ�������| A����A��B����һ�㣬��Һ��һ������c��Na+��+c��H+��=c��CH3COO-��+c��OH-�� |
| B����B��ʱ��a=12.5 |
| C����C�㣺c��CH3COO-����c��Na+����c��H+����c��OH-�� |
| D����D�㣺c��CH3COO-��=c��CH3COOH�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��֪ ��CH3COOH��2��g��?2CH3COOH ��g������ʵ���ò�ͬѹǿ�£���ϵ��ƽ��Ħ��������
��֪ ��CH3COOH��2��g��?2CH3COOH ��g������ʵ���ò�ͬѹǿ�£���ϵ��ƽ��Ħ��������. |
| M |
| m�� |
| n�� |
| A���ù��̵ġ�H��0 |
| B������ѹǿ��P��a����P��b��=P��c�� |
| C��ƽ�ⳣ����K��a��=K��b����K��c�� |
| D���ⶨ�������Է�������Ҫ�ڸ�ѹ���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��8��1 | B��4��1 |
| C��2��1 | D��1��1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ���ڷ�Ӧ2A+B?2C�ķ�Ӧ������C�İٷֺ������¶ȱ仯��ͼ��ʾ����
���ڷ�Ӧ2A+B?2C�ķ�Ӧ������C�İٷֺ������¶ȱ仯��ͼ��ʾ�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Ǧ���طŵ�ʱ�������ͳ��ʱ�ĸ���������������Ӧ |
| B���ñ���Na2CO3��Һ����BaSO4�������ɽ�BaSO4ת��ΪBaCO3 |
| C��һ���¶��£���ӦMg��1��+Cl2��g���TMgCl2��1���ġ�H��0����S��0 |
| D��pH=5��CH3COOH��Һ��pH=5��NH4C1��Һ�У�ˮ�ĵ���̶���ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
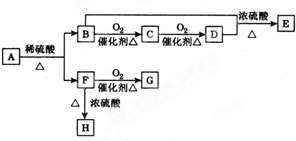 �л�����������ת����ϵ��
�л�����������ת����ϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Һ̬�廯�� | B������ |
| C���� | D��ϡ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com