
����Ŀ��Ԫ�����ڱ�����ʽ���ֶ�������ͼ������Ԫ�����ڱ���һ���֣�1��36��Ԫ�أ����Ա���ѧ����Ԫ�����ڱ���˼������Ԫ�����ڱ��������ɣ����ش��������⣺ 
��1��L������Ԫ�ش��ڳ������ڱ���λ���� �� �õ�����A2E��Ӧ�ķ���ʽΪ�� ��
��2��Ԫ��F��G��I��K��M��ԭ�Ӱ뾶�ɴ�С��˳���� �� ���Ӧ���ӵ����Ӱ뾶�ɴ�С��˳��������Ԫ�ػ����ӷ��ű�ʾ����
��3���õ���ʽ��ʾMO2�����õ���ʽ��ʾCJ2���γɹ��̣�
��4��F��G��M����Ԫ������������Ӧ��ˮ���������ǿ�������ѧʽ�����Ƚ�Ԫ��C��J�ķǽ�����ǿ����C�ķǽ�������J���ǿ���������������û�ѧ����ʽ֤���������� ��
��5��Ԫ��B��N�γɵĻ������ˮ��Һ��Ԫ��K�ĵ��ʷ�Ӧ�����ӷ���ʽΪ�� �� ��Ӧ������Һ�м���C��K�γɵĻ�������Һ������Ϊ ��
��6��A��E��A��J�����γ�18�����ӵĻ���������ֻ��������Ӧ�Ļ�ѧ����ʽΪ ��
���𰸡�
��1���������ڵ�VIII�壻3Fe+4H2O��g�� ![]() Fe3O4+4H2
Fe3O4+4H2
��2��Ca��Mg��Al��P��Cl��P3����Cl����Ca2+��Mg2+��Al3+
��3��![]() ��
��![]()
��4��Ca��OH��2������Na2CO3+H2SO4�TNa2SO4+CO2��+H2O
��5��Cl2+2Br���TBr2+2Cl������Һ�ֲ㣬�²���Һ�ʳȺ�ɫ
��6��H2O2+H2S�T2H2O+S��
���������⣺����ͼ֪��A��O�ֱ���H��Na��C��N��O��Mg��Al��Si��P��S��Cl��Fe��Ca��Br��FԪ�أ���1��L������Ԫ��ΪFeԪ�أ����ڳ������ڱ���λ���ǵ������ڵ�VIII�壬Fe��ˮ�����ڸ����·����û���Ӧ������������������������Ӧ����ʽΪ3Fe+4H2O��g�� ![]() Fe3O4+4H2 �� ���Դ��ǣ��������ڵ�VIII�壻3Fe+4H2O��g��
Fe3O4+4H2 �� ���Դ��ǣ��������ڵ�VIII�壻3Fe+4H2O��g�� ![]() Fe3O4+4H2����2��ԭ�ӵ��Ӳ���Խ����ԭ�Ӱ뾶Խ��ͬһ����Ԫ��ԭ�Ӱ뾶����ԭ�������������С��ԭ�Ӱ뾶��С˳����Ca��Mg��Al��P��Cl�����ӵ��Ӳ���Խ�࣬�����Ӱ뾶Խ���Ӳ�ṹ��ͬ�����ӣ����Ӱ뾶����ԭ�������������С�����Ӱ뾶��С˳����P3����Cl����Ca2+��Mg2+��Al3+ �� ���Դ��ǣ�Ca��Mg��Al��P��Cl��P3����Cl����Ca2+��Mg2+��Al3+����3��Caԭ�Ӻ�Fԭ��ͨ����ʧ�����γɷ����ƣ������Ƶĵ���ʽΪ
Fe3O4+4H2����2��ԭ�ӵ��Ӳ���Խ����ԭ�Ӱ뾶Խ��ͬһ����Ԫ��ԭ�Ӱ뾶����ԭ�������������С��ԭ�Ӱ뾶��С˳����Ca��Mg��Al��P��Cl�����ӵ��Ӳ���Խ�࣬�����Ӱ뾶Խ���Ӳ�ṹ��ͬ�����ӣ����Ӱ뾶����ԭ�������������С�����Ӱ뾶��С˳����P3����Cl����Ca2+��Mg2+��Al3+ �� ���Դ��ǣ�Ca��Mg��Al��P��Cl��P3����Cl����Ca2+��Mg2+��Al3+����3��Caԭ�Ӻ�Fԭ��ͨ����ʧ�����γɷ����ƣ������Ƶĵ���ʽΪ ![]() ��Cԭ�Ӻ�Sԭ��ͨ�����õ��Ӷ��γɶ���̼�����γɹ���Ϊ
��Cԭ�Ӻ�Sԭ��ͨ�����õ��Ӷ��γɶ���̼�����γɹ���Ϊ ![]() �����Դ��ǣ�
�����Դ��ǣ� ![]() ��
�� ![]() ����4��Ԫ�صĽ�����Խǿ��������������ˮ�������Խǿ�������ֽ�����������ǿ����Ca����������������ˮ���������ǿ����Ca��OH��2��Ԫ�صķǽ�����Խǿ��������������ˮ��������Խǿ��ǿ���ܺ������η�Ӧ�������ᣬ�ǽ�����S��C�������ܺ�̼���Ʒ�Ӧ���ɶ�����̼����Ӧ����ʽΪNa2CO3+H2SO4�TNa2SO4+CO2��+H2O�����Դ��ǣ�Ca��OH��2������Na2CO3+H2SO4�TNa2SO4+CO2��+H2O����5��Ԫ��B��N�γɵĻ������ˮ��ҺΪNaBr��Һ��Ԫ��K�ĵ�����������������ԭ��Ӧ��������Ȼ��ƣ����ӷ���ʽΪCl2+2Br���TBr2+2Cl������Ӧ������Һ�м���C��K�γɵĻ��������Ȼ�̼���ܷ�����ȡ�����Ȼ�̼�ܶȴ���ˮ�Һ�ˮ�����ܣ����Կ�������������Һ�ֲ㣬�²���Һ�ʳȺ�ɫ�����Դ��ǣ�Cl2+2Br���TBr2+2Cl������Һ�ֲ㣬�²���Һ�ʳȺ�ɫ����6��H��O��H��S�����γ�18�����ӵĻ�����ֱ�ΪH2O2��H2S�����߷���������ԭ��Ӧ����ˮ��S����Ӧ����ʽΪH2O2+H2S�T2H2O+S�������Դ��ǣ�H2O2+H2S�T2H2O+S����
����4��Ԫ�صĽ�����Խǿ��������������ˮ�������Խǿ�������ֽ�����������ǿ����Ca����������������ˮ���������ǿ����Ca��OH��2��Ԫ�صķǽ�����Խǿ��������������ˮ��������Խǿ��ǿ���ܺ������η�Ӧ�������ᣬ�ǽ�����S��C�������ܺ�̼���Ʒ�Ӧ���ɶ�����̼����Ӧ����ʽΪNa2CO3+H2SO4�TNa2SO4+CO2��+H2O�����Դ��ǣ�Ca��OH��2������Na2CO3+H2SO4�TNa2SO4+CO2��+H2O����5��Ԫ��B��N�γɵĻ������ˮ��ҺΪNaBr��Һ��Ԫ��K�ĵ�����������������ԭ��Ӧ��������Ȼ��ƣ����ӷ���ʽΪCl2+2Br���TBr2+2Cl������Ӧ������Һ�м���C��K�γɵĻ��������Ȼ�̼���ܷ�����ȡ�����Ȼ�̼�ܶȴ���ˮ�Һ�ˮ�����ܣ����Կ�������������Һ�ֲ㣬�²���Һ�ʳȺ�ɫ�����Դ��ǣ�Cl2+2Br���TBr2+2Cl������Һ�ֲ㣬�²���Һ�ʳȺ�ɫ����6��H��O��H��S�����γ�18�����ӵĻ�����ֱ�ΪH2O2��H2S�����߷���������ԭ��Ӧ����ˮ��S����Ӧ����ʽΪH2O2+H2S�T2H2O+S�������Դ��ǣ�H2O2+H2S�T2H2O+S����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ������У���һ����A��B�����Ϻ�����Ӧ��xA(g)��yB(g)![]() zC(g)��mD(s)��ƽ��ʱ���A��Ũ��Ϊ0.5mol/L�������¶Ȳ��䣬���������ݻ�����ԭ�����������ٴ�ƽ��ʱ�����A��Ũ��Ϊ0.3mol/L���������й��ж���ȷ����
zC(g)��mD(s)��ƽ��ʱ���A��Ũ��Ϊ0.5mol/L�������¶Ȳ��䣬���������ݻ�����ԭ�����������ٴ�ƽ��ʱ�����A��Ũ��Ϊ0.3mol/L���������й��ж���ȷ����
A. x��y��z��m B. B��ת����һ����С
C. ƽ��������Ӧ�����ƶ� D. ������������һ����С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ӦA2+B2=2AB�������仯��ͼ��ʾ��������˵����ȷ���ǣ� �� 
A.�÷�Ӧ�����ȷ�Ӧ
B.����1molA��A����1molB��B���ɷų�xkJ����
C.����2molA��B����Ҫ����ykJ����
D.2molAB������������1molA2��1molB2��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ��aA(g)��bB(g) ![]() cC(g)��dD(g)
cC(g)��dD(g)![]() H��ѧϰС����Է�Ӧ�ص����Ӧ��ͼ��չ�������ۣ���������ȷ����
H��ѧϰС����Է�Ӧ�ص����Ӧ��ͼ��չ�������ۣ���������ȷ����
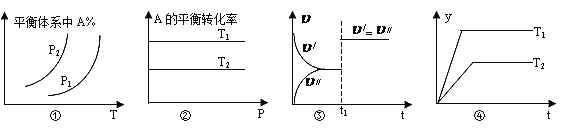
A. ͼ���У���p1��p2����÷�Ӧ�ڽϵ��¶����������Է�����
B. ͼ���У���T2��T1����![]() H��0��a��b��c��d
H��0��a��b��c��d
C. ͼ����(��/��ʾ����Ӧ���ʣ���//��ʾ�淴Ӧ����)��t1ʱ�̸ı������һ����ʹ���˴���
D. ͼ���У���![]() H��0���������겻���ܱ�ʾ���Ƿ�Ӧ���ת����
H��0���������겻���ܱ�ʾ���Ƿ�Ӧ���ת����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ3A(g)��2B(g)![]() 4 C(g)�������淴Ӧ���ʿ��ø���Ӧ���������Ũ�ȵı仯����ʾ�����и���ϵʽ����˵����Ӧ�Ѵﵽƽ��״̬����
4 C(g)�������淴Ӧ���ʿ��ø���Ӧ���������Ũ�ȵı仯����ʾ�����и���ϵʽ����˵����Ӧ�Ѵﵽƽ��״̬����
A. 3v��(A)��2v��(B) B. 2v��(A)��3v��(B) C. 4v��(C)��3v��(A) D. 3v��(A)��2v��(B)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ������N2��Mg�Ʊ�Mg3N2��װ����ͼ��ʾ������ûʳ������Һ������������������������˵����ȷ���ǣ� ��

A. ����������������ʢװŨH2SO4��Һ��NaOH��Һ������ûʳ������Һ
B. ʵ�����˳��Ϊ��ͨ��������ʽ��¯��ͨ����ȡ���ʽ��¯��ͨ�����
C. �ܵ�������Ԥ�Ⱦ�������ĵ���
D. ���ݵĴ�����ȼ�ղ�����ʱ���ݿ�ֹͣͨ�����װ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݽ̲��еġ��к��ȵIJⶨʵ�顱�����ò������������ձ�����Ͳ����ͷ�ι����⣬����Ҫ �� ��֪������10.0g�������Ƶ�ϡ��Һ��������ϡ���ᷴӦ���ų�14.3kJ������������кͷ�Ӧ���к���Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������������������������Ҫ�����á�

��ش���������:
��1��ͼ1�dz�����1 mol NO2��1 mol CO��Ӧ����CO2��NO�����е������仯ʾ��ͼ,��д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ:____________________________��
��2����ͼ2���ں��¡����ݵ��ܱ�������,ͨ��һ������N2O4������ӦN2O4(g)![]() 2NO2(g)����H��
2NO2(g)����H��
����0~60 sʱ���,��Ӧ����v(N2O4)Ϊ____ mol��L-1��s-1��
���¶�����,����������ɫ����,����H____0(����>������<��)��
���ı��������´ﵽƽ��ʱ,ҪʹN2O4������������,�ɲ�ȡ�Ĵ�ʩ��____(����ĸ)��
a.����������ͨ��N2O4 b.�����¶�
c.����������ͨ��NO2 d.ʹ�ø�Ч����
��3��ʵ���ҿ���NaOH��Һ����NO2,������Ӧ�Ļ�ѧ����ʽΪ2NO2+2NaOH![]() NaNO3+NaNO2+H2O����0.2 mol NaOH��ˮ��Һ��0.2 mol NO2ǡ����ȫ��Ӧ��1 L��ҺA,��ҺBΪ0.1 mol��L-1��CH3COONa��Һ��
NaNO3+NaNO2+H2O����0.2 mol NaOH��ˮ��Һ��0.2 mol NO2ǡ����ȫ��Ӧ��1 L��ҺA,��ҺBΪ0.1 mol��L-1��CH3COONa��Һ��
��A��B����Һ��c(NO3-)��c(NO2-)��c(CH3COO-)�ɴ�С��˳��Ϊ_________________��
(HNO2�ĵ��볣��Ka=7.1��10-4 mol��L-1,CH3COOH�ĵ��볣��Ka=1.7��10-5 mol��L-1)��
����ʹA��B����Һ��pH��ȵķ�����____(����ĸ)��
a.����ҺA�м�����ˮ b.����ҺA�м�����NaOH
c.����ҺB�м�����ˮ d.����ҺB�м�����NaOH
��4��ͭ������ϡ���ᷴӦ,Ҳ����Ũ���ᷴӦ,��ͭ��һ��Ũ�����ᷴӦʱ,�ɽ���ѧ����ʽ��ʾΪCu+HNO3![]() Cu(NO3)2+NO��+NO2��+H2O(����ʽδ��ƽ)��0.6 mol Cu��������ȫ�ܽ��,����õ���NO��NO2���ʵ�����ͬ,��μӷ�Ӧ����������ʵ���Ϊ____��
Cu(NO3)2+NO��+NO2��+H2O(����ʽδ��ƽ)��0.6 mol Cu��������ȫ�ܽ��,����õ���NO��NO2���ʵ�����ͬ,��μӷ�Ӧ����������ʵ���Ϊ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����С�������������ʵ�飬�۲첻ͬ����Ԫ�ض��Ϲ�ֲ������������Ӱ�졣��4�鵥����ȱ������ʵ���У����ǹ۲쵽����һ��ı���Ϊ��Ҷ��̬����ɫ����������Ҷ��ɫ�쳣���ʻư�ɫ������ȱ����Ԫ����
A��K B��P C��Mg D��Fe
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com