
| A. | 与Al产生H2的溶液中:Cl-、Na+、NO3- | |
| B. | 在某酸性透明的溶液中:Fe2+、H+、I- | |
| C. | 滴加KCSN试剂呈红色的溶液中:K+、SO32-、HCO3- | |
| D. | 在由水电离出的c(H+)×c(OH-)=1×10-24的溶液中:SO42-、F-、Na+ |
分析 A.在加入Al能产生H2的溶液,可能为酸或碱的溶液,则与氢离子或氢氧根离子反应的离子,一定不能存在,注意铝和硝酸不产生氢气,以此来解答;
B.在某酸性透明的溶液中Fe2+、H+、I-,相互间不反应;
C.滴加KCSN试剂说明存在Fe3+,Fe3+能够氧化SO32-;
D.在由水电离出的c(H+)×c(OH-)=1×10-24的溶液,由水电离出的c(OH-)=1×10-12mol•L-1,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性.
解答 解:A.加入Al能放出H2的溶液可能为强碱性或非氧化性酸溶液,若为酸性,NO3-、H+为强氧化性酸硝酸,与铝反应不会生成氢气,故A错误;
B.在某酸性透明的溶液中Fe2+、H+、I-,存在H+、Fe2+、H+、I-,离子之间不发生任何反应,可大量共存,故B正确;
C.滴加KCSN试剂呈红色,是因为Fe3++3SCN-=Fe(SCN)3,说明存在Fe3+,Fe3+能够氧化SO32-不能大量共存,故C错误;
D.由水电离出的c(H+)×c(OH-)=1×10-24的溶液中,水电离产生的c(H+)=c(OH-)=1×10-12mol•L-1的溶液,水的电离受到抑制,溶液可能呈酸性,也可能呈碱性,如溶液呈酸性,F-、H+反应生成弱酸HF,不可以大量共存,故D错误;
故选B.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应及习题中的信息为解答的关键,侧重氧化还原反应、复分解反应的离子共存考查,注意选项A铝和硝酸不产生氢气,题目难度不大.


 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 电池工作时,有机阳离子通过外电路移向石墨电极 | |
| B. | 若用该电池给钢制品表面电镀Al,则钢制品应该接电池的正极 | |
| C. | 电池充电时,阴极的电极反应式为4Al2Cl7-+3e-=Al+7AlCl4- | |
| D. | 若改用NaOH溶液作电解液,则Al电极的反应式为Al-3e-+3OH-=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1 | I2 | I3 | I4 | I5 | |
| 电离能/kJ•mol-1 | 738 | 1 451 | 7 733 | 10 540 | 13 630 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
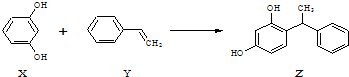
| A. | X、Z均能与Na2CO3溶液反应 | |
| B. | X可作缩聚反应单体,Y可作加聚反应单体 | |
| C. | X、Y、Z均能使溴水褪色,但是原理不相同 | |
| D. | 该反应的反应类型为取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
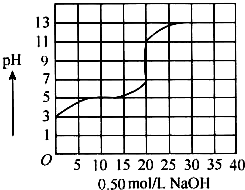 在100mL盐酸的溶液中,以0.50mol/L氢氧化钠溶液滴定后得滴定曲线如图所示,下列叙述正确的是( )
在100mL盐酸的溶液中,以0.50mol/L氢氧化钠溶液滴定后得滴定曲线如图所示,下列叙述正确的是( )| A. | 盐酸在滴定前的浓度是0.3mol/L | |
| B. | 该盐酸稀释10倍后pH为4 | |
| C. | 滴定过程为求滴定终点,指示剂只能用酚酞 | |
| D. | 若用酚酞作指示剂,滴定终点时溶液颜色的变化为红色到无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与足量CO2反应,共生成0.2mol O2,转移电子的数目为0.4NA | |
| B. | 室温下,1L pH=12的Ba(OH)2溶液中,由水电离的OH-离子数目为0.01NA | |
| C. | 0.1 mol聚丙烯中含有双键的数目为0.1NA | |
| D. | 含1mol FeCl3的饱和溶液最多可形成胶体粒子数为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com