
| A | B | C | |
| 起始浓度(mol/L) | 3.0 | 2.0 | 0 |
| 2s末浓度(mol/L) | 0.6 | 0.4 | 0.8 |
| A. | 3:1:2 | B. | 3:2:1 | C. | 2:1:3 | D. | 9:3:4 |
分析 由表格中数据可知,
aA(g)+bB(g)?cC(g)
开始 3.0 2.0 0
转化 2.4 1.6 0.8
6s 0.6 0.4 0.8
结合转化的量等于速率之比,也等于化学计量数之比计算.
解答 解:由表格中数据可知,
aA(g)+bB(g)?cC(g)
开始 3.0 2.0 0
转化 2.4 1.6 0.8
6s 0.6 0.4 0.8
则上述方程式中各物质的化学计量数之比是2.4mol/L:1.6mol/L:0.8mol/L=3:2:1,
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握表格中数据、浓度变化与化学计量数的关系为解答的关键,侧重分析与计算能力的考查,注意数据分析与应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
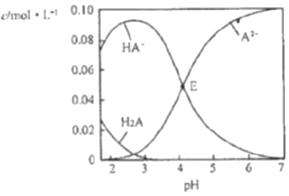
| A. | pH=2的溶液中:c(H2A)+c(A2-)>c(HA-) | |
| B. | E点溶液中:c(Na+)-c(HA-)<0.100mol•L-1 | |
| C. | c(Na+)=0.100mol•L-1的溶液中:c(H+)+c(H2A)=c(OH-)+c(A2-) | |
| D. | pH=7的溶液中:c(Na+)>2c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
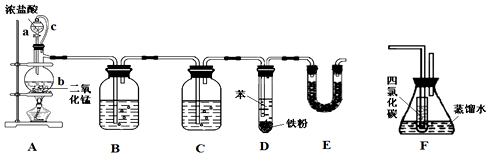
| 密度/g•cm-3 | 沸点/℃ | 水中溶解性 | |
| 苯 | 0.879 | 80.1 | 微溶 |
| 氯苯 | 1.11 | 131.7 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2与H2在一定条件下合成NH3 | B. | NH3经催化氧化生成NO | ||
| C. | NO和O2反应生成NO2 | D. | 由NH3制碳铵和尿素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
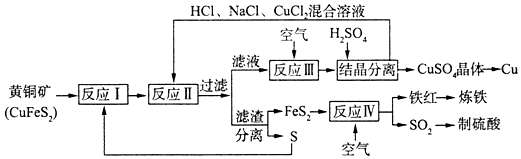
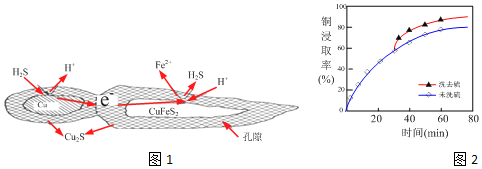
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,74g乙酸甲酯中含共用电子对数为11NA | |
| B. | 1mol Cl2通入足量的水中,转移电子数为NA | |
| C. | 足量的铁粉与200mL1 mol•L-1硝酸完全反应生成H2的分子败为0.1NA | |
| D. | 30g葡萄糖和乙酸的混合物中含碳原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:Y小于X | |
| B. | 气态氢化物的稳定性:Y大于X | |
| C. | 最高价含氧酸的酸性:X强于Y | |
| D. | X和Y形成化合物时,X显负价,Y显正价 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
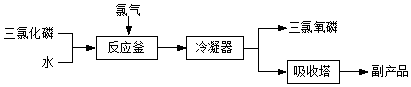
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com