

| A、KMnO4分解生成氧气 |
| B、二氧化锰和盐酸生产氯气 |
| C、碳酸钙和盐酸生成二氧化碳 |
| D、锌和盐酸生成氢气 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 83.0 |
| A、b>f |
| B、K(1000℃)>K(810℃) |
| C、915℃、2.0MPa时E的转化率为60% |
| D、该反应的△S>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹).
某化学兴趣小组的同学利用如图所示实验装置进行实验(图中a、b、c表示止水夹).
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
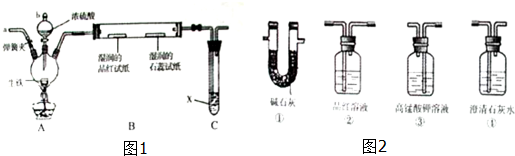
 如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:
如图是实验室制乙烯的发生装置和乙烯性质实验装置,反应原理为:| 浓硫酸 |
| 170℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| O | 2- 4 |
| O | - 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com