
在下列反应中发生了电子得失的是________;发生了电子对偏移的是________。
科目:高中化学 来源: 题型:阅读理解
 (2012?河西区一模)碳和碳的化合物在生产、生活中的应用非常广泛,此方面的科学研究为当今提倡的“低碳生活方式”提供依据.请按要求回答下列问题:
(2012?河西区一模)碳和碳的化合物在生产、生活中的应用非常广泛,此方面的科学研究为当今提倡的“低碳生活方式”提供依据.请按要求回答下列问题:
| ||
| ||
| 0 | 5 | 10 | 15 | 20 | 25 | 30 | 35 | 40 | 45 | |
| N2 | 8.00 | 7.40 | 7.00 | 6.72 | 6.52 | 6.36 | 6.20 | 6.00 | 6.00 | 6.00 |
| CO | 0.00 | 1.80 | 3.00 | 3.84 | 4.22 | 4.92 | 5.40 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
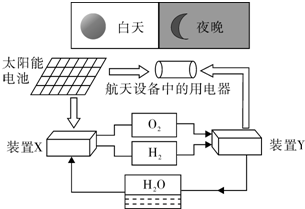 如图是一种航天器能量储存系统原理示意图.
如图是一种航天器能量储存系统原理示意图.查看答案和解析>>
科目:高中化学 来源: 题型:
闪锌矿:ZnS含量≥80%;FeS、CuS、CdS含量各约占2%。
MnO2和Zn是制造干电池的原料。电解法生产MnO2传统的工艺主要流程为:软锰矿加焦炭还原熔烧,用H2SO4浸出熔烧料,浸出液经净化然后电解,在阳极上析出MnO2。
电解制锌的传统工艺为:闪锌矿高温氧化脱硫再还原得粗锌。

将用热还原法制得的粗锌溶于硫酸,再电解ZnSO4溶液可生产纯度为99.95%的锌。
90年代生产MnO2和Zn的新工艺是通过电解获得MnO2和Zn。
![]()
![]()
试回答下列问题。
(1)已知在第①步中发生了反应:
MnO2+ZnS+2H2SO4====MnSO4+ZnSO4+S+2H2O
据此写出第①步反应中MnO2和CuS与酸反应的离子方程式:__________,软锰矿中Al2O3溶于酸的离子方程式:______________________________。
(2)产品C为____________,当第③步电解时,电路中通过1 mol电子时,阳极生成__________,其物质的量为__________。
(3)试从环境保护和能量消耗的角度,评价90年代新工艺与传统工艺相比较有哪些优点。
____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖北省部分重点中学高二上学期期中联考化学试卷 题型:填空题
(14分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。
为探究反应原理,现进行如下实验,在体积为1 L的 密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g)
密闭容器中,充入1 mol CO2和3 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
①从反应开始到平衡,氢气的平均反应速率υ(H2)=__________mol/(L·mi n)。
n)。
②该反应的平衡常数表达式为K=__________。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH=-1277 kJ·mol-1
ΔH=-1277 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
③C(s)+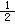 O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
④H2O(g)=H2O(l) ΔH=-44 kJ·mol-1
则,CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=________kJ·mol-1。
(3)2009年10月 ,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。
,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如下图所示。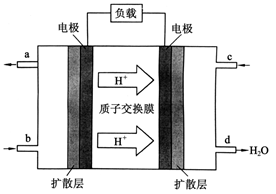
①该电池工作时,b口通入的物质为___________,c口通入的物质为___________。
②该电池负极的电极反应式为:_________________。
③工作一段时间后,当外电路中有1.2NA个电子通过时,有 g甲醇参加反应。
(4)在下列选项中与甲醇互为同系物的是_______(填字母代号),该同系物与相对分子质量相同的羧酸反应的化学方程式为______________,该反应的反应类型是____________。
试写出一种与D选项互为同分异构体且含有苯环的物质_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com