
�������N2��O2����������ֱ�Ϊ0.8��0.2���ڷ���¯�н��������ÿ���������գ�
4FeS2��11O2��2Fe2O3��8SO2
(1)����������SO2���������������________��(����һλС��)��
(2)��ʵ�������У��Ӵ���SO2��O2���������1��4��Ϊ�ʺϣ�������¯ͨ��Ӵ��ҵ�¯����SO2��O2��N2�������Ϊ8��1��48��������Ϊ2.5 m3/s���������Ӵ�����ͨ��Ŀ���������Ӧ��Ϊ________m3/s(����һλС�������������ͬ��ͬѹ�²ⶨ)��
(3)���ӽӴ��ҳ�����������SO2��O2��N2��SO3�������Ϊ0.5��1��20��x����x��________����ʱ��Ӧ��SO2��ת����Ϊ________��(����һλС��)��
(4)���᳧���ð�ˮ����β����SO2��SO3�ȣ���������Һ�м���Ũ���ᣬ����ȡ��Ũ�ȵ�SO2��(NH4)2SO4��NH4HSO4���壮Ϊ�˲ⶨ����(NH4)2SO4��NH4HSO4�����������ɣ��ֳ�ȡ����Ʒ�ķ�[(NH4)2SO4��NH4HSO4�ķֽ��¶Ⱦ�����200��]��ʵ���������£�(������ڱ���²ⶨ)

�ٸû������(NH4)2SO4��NH4HSO4�����ʵ���֮��________
������NaOH��Һ�����ʵ���Ũ�ȣ�
 С��ſ�ʱ��ҵϵ�д�
С��ſ�ʱ��ҵϵ�д� һ������ϵ�д�
һ������ϵ�д� �Ƹ�С״Ԫ���ֳ������ϵ�д�
�Ƹ�С״Ԫ���ֳ������ϵ�д� �¸��̵�ѧϵ�д�
�¸��̵�ѧϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ʱ��/min | CO | Zn | CO2 |
| 0 | 0.11 | 0 | 0 |
| 2 | 0.10 | 0.01 | 0.01 |
| 3 | 0.01 | 0.10 | 0.10 |
| 4 | 0.01 | 0.10 | 0.10 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
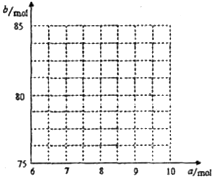
(1)1.00 mol FeS2����ȫ��������Ҫ���������(��״��)Ϊ________L��
(2)
(3)�ÿ�������FeS2���������������У�O2�ĺ���Ϊ0.080 0,����SO2�ĺ�����
(4)������FeS2��������������Ϊ

˵����Ϊ������ͼ����������13 b��ʾ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com