
某种盐溶解后得到的溶液中可能含有Fe2+、Fe3+、SO42-、NH4+、Ba2+、CO32-离子中的某几种。
(1)甲同学做如下实验:
①取少量溶液于试管中.逐滴加人浓氢氧化钠溶液,发现先生成白色沉淀.迅速变为灰绿色,最后变为红揭色,并有刺激性气体生成;
②另取少量溶液于试管中,加人少量盐酸酸化的氯化钡溶液,有白色沉淀生成。该溶液中一定含有的离子是_____;
写出①中白色沉淀转化为红褐色沉淀的化学方程式: ;
(2)乙同学做如下实验:取少量溶液于试管中,滴加几滴硫氰酸钾溶液,无明显现象;再滴加H2O2.发现溶液变红色;继续滴加H2O2,红色逐渐褪去且有气泡产生。为弄清其中缘由,他查阅资料知:H2O2+SCN—→SO42—+CO2↑+N2↑+H2O+H+(SCN—中S为—2价)
①该反应中,被氧化的元素为__________,每生成1molCO2转移的电子数为___________;
②根据乙同学的实验现象,请判断还原性强弱为:Fe2+__________NCN-(填<、=或>);
③根据资料,乙同学提出的猜想是:H2O2将SCN-氧化使红色逐渐褪去。请你设计一个实验,验证乙同学的猜想是否正确_____________________________________________。
(1)(1)Fe2+、SO42-、NH4+(少1种扣1分,多写、写错不得分);4Fe(OH)2+O2+2H2O=4Fe(OH)3;(2)①N、S;11;② >;③取少量褪色后的溶液于试管中,滴加KSCN溶液,若溶液恢复红色,证明乙同学推断正确
【解析】
试题分析:(1)取少量溶液于试管中,逐滴加入浓氢氧化钠溶液,发现开始生成白色沉淀,白色沉淀迅速变为灰绿色,最后变为红褐色,同时伴有刺激性气体放出,因此根据实验现象可知,白色沉淀是氢氧化亚铁,最终被氧化生成了氢氧化铁,因此原溶液中含有亚铁离子,则一定没有CO32-;产生的刺激性气味的气体是氨气,所以溶液中还含有NH4+;②另取少量溶液于试管中,加入足量盐酸酸化后再滴加氯化钡溶液,有白色沉淀生成,该白色沉淀应该是硫酸钡,所以溶液中含有SO42-,因此一定没有Ba2+,所以该溶液中一定含有的离子是Fe2+、SO42-、NH4+;氢氧化亚铁极易被氧化生成氢氧化铁,反应的方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。(2)①根据反应H2O2+SCN-→SO42-+CO2↑+N2↑+H2O+H+可知,双氧水中氧元素的化合价从-1价降低到-2价,得到电子,被还原,双氧水是氧化剂。SCN-中S和N元素的化合价分别从-2价和-3价升高到+6价和0价,所以被氧化的元素是N和S。KSCN是还原剂,所以每生成lmol CO2转移的电子的物质的量=(6+2+0+3)mol=11mol,因此电子个数为11NA。②取少量溶液于试管中,滴加几滴硫氰酸钾溶液,无明显现象;再滴加H2O2,发现溶液变红色,此时亚铁离子被氧化生成了铁离子,铁离子与KSCN溶液反应显红色;继续滴加H2O2,红色逐渐褪去且有气泡产生,这说明此时KSCN溶液被氧化,所以还原性强弱为:Fe2+>SCN-。③如果是H2O2将SCN-氧化使红色逐渐褪去,则只需要取少量褪色后的溶液于试管中,滴加KSCN溶液,若溶液恢复红色,即可证明乙同学推断正确
考点:化学实验;离子的检验;氧化还原反应


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源:2014-2015学年广东省惠州市高三第三次调研考试化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.丙烯和丙烷可用Br2的CCl4溶液来区别
B.淀粉水解的最终产物是葡萄糖
C.米酒变酸的过程涉及了氧化反应
D.石油分馏和石油的裂化都属于化学变化
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省濉溪县高三第二次月考化学试卷(解析版) 题型:选择题
常温下,下列各组物质中,Y既能与X反应,又能与Z反应的是
选项 | X | Y | Z |
① | N2 | Mg | CO2 |
② | KOH溶液 | SiO2 | 氢氟酸 |
③ | O2 | N2 | H2 |
④ | 稀硝酸 | Fe | FeCl3溶液 |
A.①② B.①③ C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三下学期初考理综化学试卷(解析版) 题型:实验题
Ⅰ.实验室常见的几种气体发生装置如图A、B、C所示:
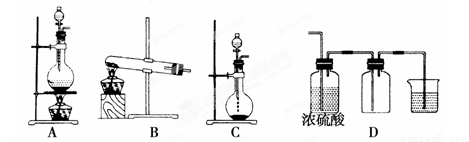
(1)实验室可以用B或C装置制取氨气,如 果用B装置制取氨气其化学反应方程式为 。
果用B装置制取氨气其化学反应方程式为 。
(2)气体的性质是选择气体收集方法的主要依据。下列性质与收集方法无关的是_______________(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可以是下列气体中的________。
①CO2 ②NO ③Cl2 ④H2 ⑤HCl
其中在D装置中连接小烧杯的目 的是____________________。
的是____________________。
Ⅱ.某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X。为确定其组成,进行如下实验 。
(1)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________,制备X的化学方程式为______________________________________;
(2)氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL cl mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。
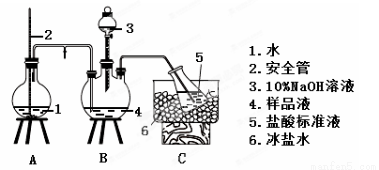
氨的测定装置(已省略加热和夹持装置)
①装置中安全管的作用原理是__________________________________________。
②样品中氨的质量分数表达式为________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三下学期初考理综化学试卷(解析版) 题型:选择题
在55℃时,下列说法正确的是
A.向水中加入少量硫酸氢钠固体,促进了水的电离,c(H+)增大,Kw不变
B.pH=8的NaHCO3溶液中:c(OH-)=1×10-6mol/L
C.饱和氯水中: c(Cl-)=c(ClO-)+c(HClO)
D.0.1mol/L的(NH4)2SO4溶液中:c(SO42-)> c(NH4+) > c(H+) > c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期中化学试卷(解析版) 题型:选择题
在水溶液中能大最共存的一组离子是
A.Fe2+ Al3+ ClO- Cl— B.K+ Cu2+ OH- NO3—
C.Na+ Ba2+ Cl— NO3— D.Mg2+ H+ SO42— SiO32—
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期中化学试卷(解析版) 题型:选择题
将a气体通人BaCl2溶液中,没有沉淀生成.然后再通人b气体,有沉淀生成,则a,b不可能
A.a是Cl2,b是CO2 B.a是SO2,b是H2S
C.a是NH3,b是CO2 D.a是SO2,b是Cl2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济南市高三上学期期末考试化学试卷(解析版) 题型:选择题
下图是一氧化碳空气燃料电池的工作原理示意图,a、b均为惰性电极。下列叙述中,正确的是
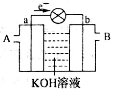
A.a电极发生还原反应,b电极发生氧化反应
B.a电极的电极反应式为:CO+4OH-+2e-=CO2+2H2O
C.A处通入的是空气,B处通入的是CO
D.用这种电池作电源精炼铜,若阴极质量增加6.4 g,则至少消耗标准状况下的CO 2.24 L
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南省高三12月月考化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值。下列叙述正确的是
A.1molFeCl3跟沸水反应转化成氢氧化铁胶体后,生成胶体微粒的数目为NA
B.电解精炼铜时,若转移了NA个电子,则阴极析出32 g铜
C.6.8克熔融的KHSO4中含有0.1NA个阳离子
D.标准状况下,11.2L四氯化碳所含分子数为0.5NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com