
| A. | SO42- | B. | NH3 | C. | C2H6 | D. | SO2 |
分析 根据VSEPR理论和杂化轨道理论判断粒子的空间构型和杂化轨道,据此分析解答.
解答 解:A.SO42-,根据VSEPR理论,配位原子数为BP=4,孤电子对数为LP=$\frac{6-2×4+2}{2}$=0,则价电子对数为VP=BP+LP=4+0=4,根据杂化轨道理论,中心S原子为sp3杂化,故A不选;
B.NH3,根据VSEPR理论,配位原子数为BP=3,孤电子对数为LP=$\frac{5-1×3}{2}$=1,则价电子对数为VP=BP+LP=3+1=4,根据杂化轨道理论,中心N原子为sp3杂化,故B不选;
C.乙烷C2H6中,C均成四个共价键,因此C为sp3杂化,故C不选;
D.SO2,根据VSEPR理论,配位原子数为BP=2,孤电子对数为LP=$\frac{6-2×2}{2}$=1,则价电子对数为VP=BP+LP=2+1=3,根据杂化轨道理论,中心S原子为sp2杂化,故D可选.
故选D.
点评 本题考查价层电子对互斥理论和杂化轨道理论的简单应用,判断粒子的空间构型和杂化轨道类型.本题难度不大,是基础题.


 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案科目:高中化学 来源: 题型:解答题
 硫单质及其化合物在工农业生产中有着重要的应用.
硫单质及其化合物在工农业生产中有着重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
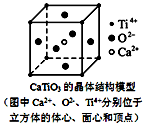
| A. | 分子晶体中都存在共价键 | |
| B. | 右图CaTiO3晶体中每个Ti4+与12个O2-相紧邻 | |
| C. | SiO2晶体中每个硅原子与两个氧原子以共价键相结合 | |
| D. | 在二氧化硅晶体中,最小环上的原子个数是六 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 200℃时,反应从开始到平衡的平均速率 v(A)=0.08 mol•L-1•min-1 | |
| B. | 若 0~5 min 时容器与外界的热交换总量为 m kJ,则该反应的热化学方程式可表示为:2A(g)+B(g)?C(g)△H=+5m kJ/mol | |
| C. | 200℃时,若在第 6 min 再向体系中加入催化剂,可使 v 正>v 逆 | |
| D. | 200℃时,平衡后再充入 2 mol C,则达到平衡时,化学平衡常数变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两份质量相同的Al分别加入到足量NaOH溶液和盐酸中充分反应,盐酸增加的质量大 | |
| B. | 两份质量相同的S分别与足量NaOH溶液和Na反应,两者转移的电子数相同 | |
| C. | 相同物质的量的CO2、H2O分别与足量Na2O2反应,生成气体的物质的量相同 | |
| D. | H2分别通过灼热的CuO和Fe2O3粉末,当转移电子数相同时,Fe2O3减轻的质量大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验证实,不存在两种邻二甲苯,所以现代物质结构理论认为苯分子中碳碳键完全相同,而不是单双键交替结构 | |
| B. | 两种有机物若具有相同的摩尔质量,不同的结构,则一定是互为同分异构体 | |
| C. | 醛能发生银镜反应,但发生银镜反应的有机物不一定是醛类 | |
| D. | 等质量的两种有机物完全燃烧生成等质量的水,则两有机物中氢元素的质量分数必须是相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取7.68g CuSO4,加入480mL水 | B. | 称取12.0g胆矾配成500 mL溶液 | ||
| C. | 称取8.0g CuSO4,加入500 mL水 | D. | 称取12.5g胆矾配成500 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
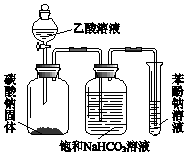 某同学欲用如图所示装置比较苯酚、乙酸、碳酸的酸性强弱,实验进行一段时间后,盛有苯酚钠溶液的试管中溶液变浑浊.
某同学欲用如图所示装置比较苯酚、乙酸、碳酸的酸性强弱,实验进行一段时间后,盛有苯酚钠溶液的试管中溶液变浑浊.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白磷和红磷互为同素异形体 | |
| B. | CH3-CH2OH和 CH3-O-CH3互为同分异构体 | |
| C. | ${\;}_{2}^{3}$He和${\;}_{2}^{4}$He互为同位素 | |
| D. | ${\;}_{2}^{4}$He的最外层电子数为2,所以${\;}_{2}^{4}$He具有较强的金属性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com