
| y |
| 4 |
| y |
| 4 |
| y |
| 4 |
| y |
| 4 |
| y |
| 4 |
| y |
| 4 |
| 9.0g |
| 18g/mol |
| 17.6g |
| 44g/mol |
| y |
| 4 |
| y |
| 4 |


科目:高中化学 来源: 题型:
| A、增加Fe的物质的量 |
| B、保持体积不变,充入水蒸气使体系压强增大 |
| C、将容器的体积缩小一半 |
| D、压强不变,充入Ne使容器的体积增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,1L pH=12的Ba(OH)2溶液中含有的OH-数为0.01NA |
| B、常温下,1L 0.1mol/L的CH3COOH溶液中含有的H+数为0.1NA |
| C、11.2 L乙烯、乙烷的混合气体中含有的碳原子数为NA |
| D、5.6 g Fe和足量盐酸完全反应,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
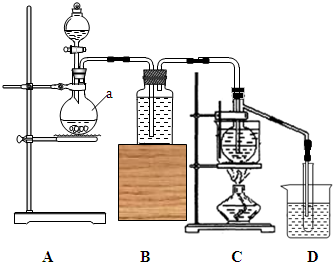 实验室利用如图所示装置,用电石为原料,在90℃左右,用HgSO4催化乙炔水化制备乙醛.(已知常温下乙炔在水中溶解度约为1:1(体积比))
实验室利用如图所示装置,用电石为原料,在90℃左右,用HgSO4催化乙炔水化制备乙醛.(已知常温下乙炔在水中溶解度约为1:1(体积比))查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | ||
| Z | M | R |
| A、气态氢化物稳定性:X>Y |
| B、最高价氧化物的水化物的酸性:Y>M |
| C、Z单质是一种常用的半导体材料 |
| D、Z、M、R的原子半径依次增大,最高化合价依次升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com