
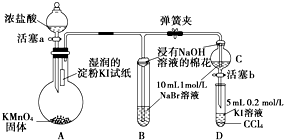
 实验题为验证卤素单质氧化性的强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验).
实验题为验证卤素单质氧化性的强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验).分析 Ⅰ.(1)氯气氧化性强于单质碘,碘遇淀粉变蓝色;
(2)氯气的氧化性强于溴,将氯气通入NaBr溶液中会有单质溴生成,发生反应的离子方程式为:Cl2+2Br-═Br2+2Cl-;
(3)为验证溴的氧化性强于碘,实验时应避免氯气的干扰;
Ⅱ.(1)氯气污染环境,浸有NaOH溶液的棉花团可以吸收多余的氯气;
(2)从原子结构(电子层数、原子半径)的角度分析.
解答 解:(1)淀粉变蓝色,说明有单质碘生成,也说明氯气氧化性强于单质碘,故答案为:湿润的淀粉KI试纸变蓝;
(2)氯气的氧化性强于溴,将氯气通入NaBr溶液中会有单质溴生成,发生反应的化学方程式为:Cl2+2NaBr=2NaCl+Br2故答案为:Cl2+2NaBr=2NaCl+Br2;
(3)为验证溴的氧化性强于碘,实验时应避免氯气的干扰,当B中溶液由黄色变为棕红色时,说明有大量的溴生成,此时应关闭活塞a,否则氯气过量,影响实验结论,
故答案为:确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰;
Ⅱ.(1)氯气污染环境,浸有NaOH溶液的棉花团可以吸收多余的氯气,所以整个实验过程中,尾气处理的方式是浸有NaOH溶液的棉花团吸收多余的氯气,故答案为:浸有NaOH溶液的棉花团吸收多余的氯气;
(2)因同一主族元素,从上到下,电子层数依次增多,原子半径逐渐增大,元素的金属性逐渐增强,得电子能力逐渐减弱,所以氯、溴、碘单质的氧化性逐渐减弱,
故答案为:电子层数依次增多,原子半径逐渐增大,元素的金属性逐渐增强.
点评 本题为探究题和实验设计题,用以比较卤素单质的氧化性强弱,注意本题中要排除干扰因素的存在.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
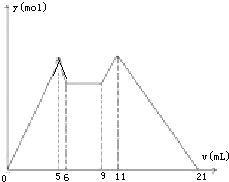 如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )
如图是向MgCl2、AlCl3混合溶液中,开始滴加6ml试剂A,之后改滴试剂B,所得沉淀y mol与试剂体积V(ml)间的关系.以下结论不正确的是( )| A. | A是盐酸,B是NaOH,且C(NaOH)=2C(HCl) | |
| B. | 原混合液中,C(Al3+):C(Mg2+):C(Cl-)=1:1:5 | |
| C. | A是NaOH,B是盐酸,且C(NaOH):C(HCl)=2:1 | |
| D. | 从6到9,相应离子反应式H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 碳元素能够形成不同的单质,如C60、C70、金刚石等等.
碳元素能够形成不同的单质,如C60、C70、金刚石等等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | t1时减小了A(g)的浓度,增加了C(g)的浓度,平衡向逆反应方向移动 | |
| B. | t1时升高了温度,平衡向逆反应方向移动 | |
| C. | t1时增加了A(g)和B(g)的浓度,平衡向正反应方向移动 | |
| D. | t1时减小了压强,平衡向逆反应方向移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com