
下列物质不能以食盐为原料而生产的是( )
| A.盐酸 | B.硫酸 | C.烧碱 | D.纯碱 |
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:问答题
某化学小组在实验室模拟用软锰矿(主要成分MnO2,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
① 缓慢向烧瓶中(见图)通入过量混合气进行“浸锰”操作,主要反应原理为: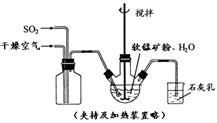
SO2+ H2O = H2SO3
MnO2+ H2SO3 = MnSO4+ H2O
(铁浸出后,过量的SO2 会将Fe3+还原为Fe2+)
② 向“浸锰”结束后的烧瓶中加入一定量纯MnO2粉末。
③ 再用Na2CO3溶液调节pH为3.5左右,过滤。
④ 调节滤液pH为6.5~7.2 ,加入NH4HCO3 ,有浅红色的沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
回答:
(1)“浸锰”反应中往往有副产物MnS2O6 的生成,温度对“浸锰”反应的影响如下图,为减少MnS2O6的生成,“浸锰”的适宜温度是 。
(2)查阅表1,③中调pH为3.5时沉淀的主要成分是 。②中加入一定量纯MnO2粉末的主要作用是 ,相应反应的离子方程式为 。
表1:生成相应氢氧化物的pH
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Cu(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列有关工业生产的叙述正确的是
| A.合成氨生产过程中升高温度可加快反应速率,缩短生产周期,故温度越高越好 |
| B.硫酸工业中,使用催化剂是为了提高SO2转化为SO3的转化率 |
| C.电解精炼铜时,精铜作阴极 |
| D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列工业生产中,有关关系式错误的是
| A.漂白粉:2Cl2—Ca(ClO)2 | B.H2SO4:FeS2—2H2SO4 |
| C.氨:C—H2—2/3 NH3 | D.HNO3: NH3—HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用下图所示的工艺流程生产硫酸:
请回答下列问题:
①为充分利用反应放出的热量,接触室中应安装________(填设备名称)。吸收塔中填充有许多瓷管,其作用是___________________________________。
②为使硫黄充分燃烧,经流量计1通入燃烧室的氧气过量50%,为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为________。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为________(空气中氧气的体积分数按0.2计),该尾气的处理方法是________。
③与以硫铁矿为原料的生产工艺相比,该工艺的特点是________(可多选)。
A.耗氧量减少 B.二氧化硫的转化率提高
C.产生的废渣减少 D.不需要使用催化剂
(2)硫酸的用途非常广泛,可应用于下列哪些方面________(可多选)。
A.橡胶的硫化
B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产
D.过磷酸钙的制备
(3)矿物燃料的燃烧是产生大气中SO2的主要原因之一。在燃煤中加入适量的石灰石,可有效减少煤燃烧时SO2的排放,请写出此脱硫过程中反应的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
2013年诺贝尔化学奖授予美国科学家马丁·卡普拉斯、迈克尔·莱维特、阿里耶·瓦谢勒,以表彰他们“在开发多尺度复杂化学系统模型方面所做的贡献”。这种用电脑取代木棒作试验模型,催生了现代化学研究手段的一次新飞跃。下列不属于现代化学对物质结构进行研究的手段的是( )
| A.X射线 | B.天平 | C.质谱 | D.核磁共振 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某工厂用CaSO4、H2O、NH3、CO2制备(NH4)2SO4。其工艺流程如下:
下列推断不合理的是 ( )。
| A.往甲中通CO2有利于(NH4)2SO4生成 |
| B.生成1 mol(NH4)2SO4至少消耗2 mol NH3 |
| C.在实际生产中CO2可被循环使用 |
| D.直接蒸干滤液能得到纯净的(NH4)2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于可逆反应N2(g)+3H2(g) 2NH3(g)(正反应为放热反应),下列说法中正确的是( )。
2NH3(g)(正反应为放热反应),下列说法中正确的是( )。
| A.达到平衡后加入N2,当重新达到平衡时,NH3的浓度比原平衡的大,H2的浓度比原平衡也大 |
| B.达到平衡后,升高温度,既加快了正、逆反应的速率,又提高了NH3的产率 |
| C.达到平衡后,缩小容器的体积,既有利于加快正、逆反应速率,又有利于提高氢气的转化率 |
| D.加入催化剂可以缩短达到平衡的时间,是因为正反应速率增大了,逆反应速率减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com