
【题目】在C(s)+CO2(g)![]() 2CO(g)反应中,可使反应速率增大的措施是
2CO(g)反应中,可使反应速率增大的措施是
①压缩容器体积 ②增加炭的量 ③恒容下通入CO2 ④恒压下充入N2 ⑤恒容下充入N2 ⑥升高温度
A.①③⑥B.②④⑥C.①③④D.③⑤⑥
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】(1)现有下列物质 ①NaCl晶体②液态SO2③冰醋酸④硫酸钡⑤铜⑥酒精(C2H5OH)⑦熔化的KCl⑧NaOH溶液⑨氯水⑩纯盐酸,请用以上物质回答下列问题。
属于强电解质且在上述状态下能导电的是____________;属于弱电解质的是_____________; 属于非电解质,但溶于水后的水溶液能导电的是______________。
(2)在密闭容器中,使1 mol N2和3 mol H2混合发生下列反应:N2 (g)+3H2 (g)![]() 2NH3 (g) ΔH <0。
2NH3 (g) ΔH <0。
①达到平衡时, 充入N2并保持体积不变,平衡将______移动(填“正向”、“逆向”或“不”)。
②达到平衡时,充入氩气(Ar)并保持体积不变,平衡将______移动(同上)。
③达到平衡时,充入氩气(Ar),并保持压强不变,平衡将______移动(同上)。
④达到平衡时,将c(N2)、c(H2)、c(NH3)同时增大1倍,平衡______移动(同上)。
⑤保持体积不变,升高温度时,混和气体的平均相对分子质量______,密度_______(填“变大”、“变小”或“不变”)。
⑥当反应达到平衡时,N2和H2的浓度比是______;N2和H2的转化率比是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与化学平衡类似,电离平衡的平衡常数,叫做电离常数(用K表示)。下表是某温度下几种常见弱酸的电离平衡常数:
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOH | 2×10﹣5 |
HClO | HClO | 3.0×10﹣8 |
H2CO3 | H2CO3 HCO3﹣ | K1=4.4×10﹣7 K2=5.61×10﹣11 |
H3PO4 | H3PO4 H2PO4﹣ HPO42﹣ | K1=7.1×10﹣3 K2=6.3×10﹣8 K3=4.2×10﹣13 |
回答下列问题:
(1)若把CH3COOH、HClO、H2CO3、HCO3﹣、H3PO4、H2PO4﹣、HPO42﹣都看作是酸,则它们酸性最强的是_______(填化学式,下同),最弱的是________。
(2)向NaClO溶液中通入少量的二氧化碳,发生的离子方程式为_______。
(3)求出该温度下,0.10molL﹣
(4)该温度下0.1mol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是____。
A.c(H+) B.c(H+)c(CH3COO﹣) C.c(H+)c(OH﹣) D.c(OH﹣)/c(H+)
(5)取等体积的pH均为a的醋酸和次氯酸两溶液,分别用等浓度的NaOH稀溶液恰好中和,消耗的NaOH溶液的体积分别为V1,V2,则大小关系为:V1_____V2( 填“>”、“<”或“=”)。
(6)下列四种离子结合H+能力最强的是_______。
A.HCO3﹣ B.CO32﹣ C.ClO﹣ D.CH3COO﹣
(7)等物质的量的苛性钠分别用pH为2和3的醋酸溶液中和,设消耗醋酸溶液的体积依次为Va、Vb,则两者的关系正确的是(_________)
A.Va>10Vb B.Va<10Vb C.Vb <10 Va D.Vb>10Va
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
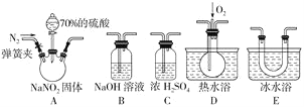
已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.5L某浓度的NaCl溶液中含有0.5molNa+,下列对该溶液的说法中,正确的是( )
A.该溶液中含有58.5gNaCl
B.配制100mL该溶液需用托盘天平称取5.85gNaCl
C.量取100mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1mol
D.将0.5molNaCl溶于0.5L水中可得到该溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种大气污染物。工业尾气中含有H2S,会造成严重的环境污染;未脱除H2S的煤气,运输过程中还会腐蚀管道。
(1)干法氧化铁脱硫是目前除去煤气中H2S的常用方法,其原理如图所示。
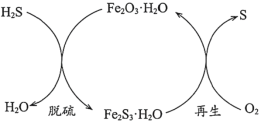
①下列说法正确的是____________(填序号)。
a.单质硫为淡黄色固体
b.脱硫反应为3H2S+Fe2O3·H2O=3H2O+Fe2S3·H2O
c.再生过程中,硫元素被还原
d.脱硫过程中,增大反应物的接触面积可提高脱硫效率
②从安全环保的角度考虑,再生过程需控制反应温度不能过高的原因是_______。
(2)电化学溶解一沉淀法是一种回收利用H2S的新方法,其工艺原理如下图所示。
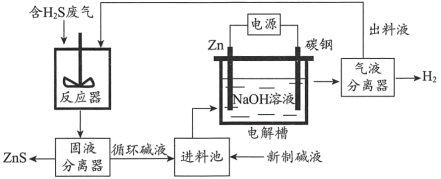
已知: Zn与强酸、强碱都能反应生成H2;Zn(II)在过量的强碱溶液中以[Zn(OH)4]2-形式存在。
①锌棒连接直流电源的____________(填“正极”或“负极”)。
②反应器中反应的离子方程式为____________。
③电解槽中,没接通电源时已经有H2产生,用化学用语解释原因:___________。
(3)常用碘量法测定煤气中H2S的含量,其实验过程如下:
i.将10L煤气通入盛有100mL锌氨络合液的洗气瓶中,将其中的H2S全部转化为ZnS沉淀,过滤;
ii.将带有沉淀的滤纸加入盛有15mL 0.1mol/L碘标准液、200mL水和10mL盐酸的碘量瓶中,盖上瓶塞,摇动碘量瓶至瓶内滤纸摇碎,置于暗处反应10 min后,用少量水冲洗瓶壁和瓶塞。(已知:ZnS+I2=ZnI2+S)
iii.用0.1mol/L Na2S2O3标准液滴定,待溶液呈淡黄色时,加入1mL淀粉指示剂,继续滴定至终点。(已知:2Na2S2O3+I2=Na2S4O6+2NaI)
①i中,将煤气中的H2S转化为ZnS的目的是____________。
②滴定终点的现象是__________________。
③若消耗Na2S2O3标准液的体积为20mL,则煤气中![]() 的含量为_______________mg/m3。
的含量为_______________mg/m3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,发生可逆反应:3A(g)![]() 3B+C(正反应为吸热反应),平衡时,升高温度,气体的平均相对分子质量有变小的趋势,则下列判断中正确的是
3B+C(正反应为吸热反应),平衡时,升高温度,气体的平均相对分子质量有变小的趋势,则下列判断中正确的是
A.B和C可能都是固体B.B和C一定都是气体
C.若C为固体,则B一定是气体D.B和C不可能都是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应mA(g)![]() nB(g)+pC(s)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
nB(g)+pC(s)达平衡后,保持温度不变,将容器体积增加一倍,当达到新的平衡时,B的浓度是原来的60%,则
A.m<n+pB.物质A的转化率减小
C.物质B的质量分数减小D.平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设N A 代表阿伏加德罗常数的值,下列说法正确的是
A. 1 mol Na在空气中完全燃烧,转移的电子数为2 N A
B. 常温下,2.7 g铝与足量NaOH溶液反应,消耗0.1 N A个OH-
C. 0.1 mol Fe 与足量水蒸气反应,生成H2的分子数为0.1 N A
D. 11.2 L Cl2含有的原子数为N A
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com