
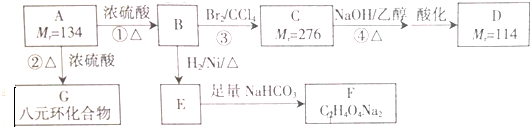
分析 根据题中各物质转化关系,A在浓硫酸作用下加热发生消去反应生成B,B与氢气发生加成反应生成E,E与碳酸氢钠反应生成F,根据F的分子式可知,E中含有两个羧基,B与溴发生加成反应生成C,C在氢氧化钠的醇溶液中发生消去反应,再酸化生成D,比较A、C、D的相对分子质量,且A在浓硫酸作用下加热也能生成八元素环G,可知A中有醇羟基和羧基,两个A分子之间发生酯化(取代)反应生成G,所以可推知A为HOOCCH2CHOHCCOOH,B为HOOCCH=CHCCOOH,C为HOOCCHBrCHBrCCOOH,D为HOOCC≡CCOOH,进而推得E为HOOCCH2CH2COOH,F为NaOOCCH2CH2COONa,据此答题.
解答 解:根据题中各物质转化关系,A在浓硫酸作用下加热发生消去反应生成B,B与氢气发生加成反应生成E,E与碳酸氢钠反应生成F,根据F的分子式可知,E中含有两个羧基,B与溴发生加成反应生成C,C在氢氧化钠的醇溶液中发生消去反应,再酸化生成D,比较A、C、D的相对分子质量,且A在浓硫酸作用下加热也能生成八元素环G,可知A中有醇羟基和羧基,两个A分子之间发生酯化(取代)反应生成G,所以可推知A为HOOCCH2CHOHCCOOH,B为HOOCCH=CHCCOOH,C为HOOCCHBrCHBrCCOOH,D为HOOCC≡CCOOH,进而推得E为HOOCCH2CH2COOH,F为NaOOCCH2CH2COONa,
(1)根据上面的分析可知,反应①为消去反应,反应②为酯化(取代)反应,
故答案为:消去反应;酯化(取代)反应;
(2)B为HOOCCH=CHCCOOH,B所含官能团的名称是羧基和碳碳双键,
故答案为:羧基和碳碳双键;
(3)根据上面的分析可知,E为HOOCCH2CH2COOH,
故答案为:HOOCCH2CH2COOH.
点评 本题考查了有机物的推断,根据转化关系及有关物质的相对分子质量进行推断是解本题关键,解题时要知道有机物的官能团及其性质,了解有机物的断键和成键方式,难度中等.


科目:高中化学 来源: 题型:多选题
| A. | 2 C6H5ONa+H2O+CO2→2 C6H5OH+Na2CO3 | |
| B. | C6H5ONa+H2O+CO2→C6H5OH+NaHCO3 | |
| C. | C6H5OH+Na2CO3→C6H5ONa+NaHCO3 | |
| D. | C6H5OH+NaHCO3→C6H5ONa+H2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
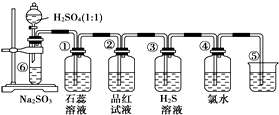 如图是实验室制备SO2并验证SO2某些性质的装置图.
如图是实验室制备SO2并验证SO2某些性质的装置图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
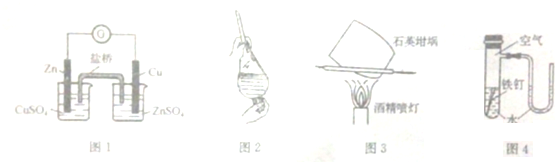
| A. | 用图1装置构成锌--铜原电池 | |
| B. | 用图2装置选择裂化汽油提取溴水中溴 | |
| C. | 用图3装置灼烧碳酸钙制取少量氧化钙 | |
| D. | 用图4装置验证在该条件下铁钉发生吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
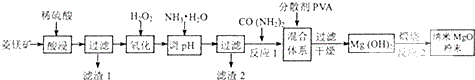
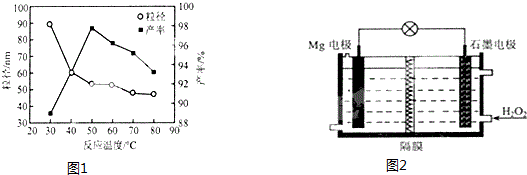
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定序号 | 待测溶液的体积/mL | 所耗盐酸标准液的体积/mL | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.52 |
| 2 | 20.00 | 1.20 | 21.18 |
| 3 | 20.00 | 0.80 | 24.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
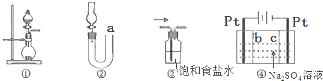
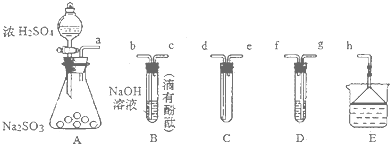
| A. | 图①可用于实验室制取少量NH3或O2 | |
| B. | 可用从a处加水的方法检验图②装置的气密性 | |
| C. | 实验室可用图③的方法除去Cl2中混有的HCl | |
| D. | 利用图④装置制硫酸和氢氧化钠,其中b为阳离子交换膜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com